
 C(g)+D(g),能说明反应已达到平衡状态的事实是
C(g)+D(g),能说明反应已达到平衡状态的事实是科目:高中化学 来源:不详 题型:单选题
 2R(g);△H>0 ,y 轴表示的是
2R(g);△H>0 ,y 轴表示的是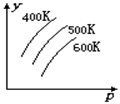
| A.平衡时,混合气中R的百分含量 |
| B.平衡时,混合气中G的百分含量 |
| C.G的转化率 |
| D.L的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
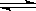 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 A2(g)+3B2(g) ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是
A2(g)+3B2(g) ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8× 10-19 10-19 |
| AlAsO4 | 1.6×1 0-16 0-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 W+Z,反应速率(V)随时间(t)变化的情况如图所示。
W+Z,反应速率(V)随时间(t)变化的情况如图所示。 表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
A. 时条件改变引起的变化是平衡向正反应方向移动 时条件改变引起的变化是平衡向正反应方向移动 |
B.若 改变 改变 的条件是压强,则W、Z均为气体,X、Y中只有一种为气体 的条件是压强,则W、Z均为气体,X、Y中只有一种为气体 |
C.若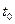 改变的条件是温 改变的条件是温 度,则该反应的正反应是吸热反应 度,则该反应的正反应是吸热反应 |
D.若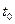 改变的条件是浓度,改变的方法是减小X、Y的浓度 改变的条件是浓度,改变的方法是减小X、Y的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)
体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)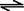 XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
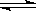 C(g)+2D(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述一定正确的是
C(g)+2D(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述一定正确的是| A.正反应是吸热反应,且A不是气态 |
| B.正反应是放热反应,且A是气态 |
| C.加入少量C,物质A的转化率增大 |
| D.改变压强对该平衡的移动无影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是 体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p 化
化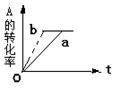
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com