
| A.所有非金属元素都分布在p区 |
| B.最外层电子数为2的元素都分布在s区 |
| C.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| D.同一主族元素从上到下,金属性呈周期性变化 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:不详 题型:填空题
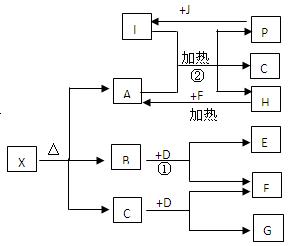
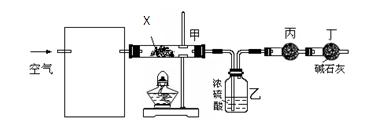
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
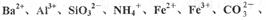
 中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
 根据现象就可判般,则该试剂最好是:______________①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸⑤KSCN溶液,⑥KMnO4溶液。
根据现象就可判般,则该试剂最好是:______________①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸⑤KSCN溶液,⑥KMnO4溶液。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
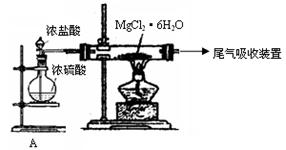
 镁,主要过程如下:
镁,主要过程如下: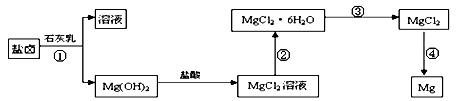
 回答下列问题:
回答下列问题: 。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X与Y | B.X与W | C.Y与Z | D.Y与W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s 2 2s1 2p1 | B.1s2 2s2 2p3 3s1 |
| C.1s2 2s2 2p6 3s1 4s1 | D.1s2 2s2 2p6 3s2 3p6 4s1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 E的阴离子结构示意图: (1分)
E的阴离子结构示意图: (1分) 得气体通入1L
得气体通入1L  1mol·L-1
1mol·L-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com