
分析 (1)利用Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等计算;
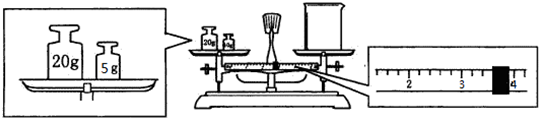
(2)依据天平平衡原理:左盘内质量=右盘内质量+游码数值,据此计算.
解答 解:(1)实验室配制50g 质量分数为21.2%的Na2CO3溶液,需要Na2CO3的质量为:50×21.2%=10.6克,Na2CO3的物质的量为0.1mol,Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等,Na2CO3•10H2O的物质的量为0.1mol,Na2CO3•10H2O的质量为:0.1mol×286g/mol=28.6g,故答案为:28.6;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得碳酸钠晶体的质量为25g-3.6g=21.4g.
故答案为:砝码和物品位置颠倒;21.4.
点评 本题考查了一定质量分数浓度溶液的配制,明确原理及天平的使用方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ):
):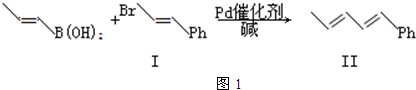
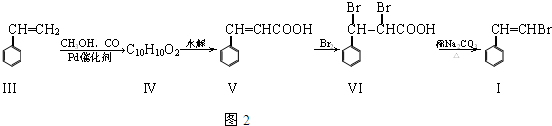
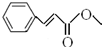 ;
; .
.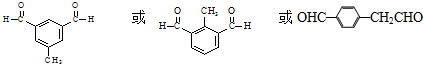 .
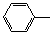
.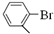 )与化合物【
)与化合物【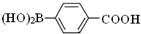 】也能发生类似反应①的偶联反应,写出产物的结构简式
】也能发生类似反应①的偶联反应,写出产物的结构简式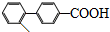 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 R1COOH+R2COOH (R1、R2代表烃基)
R1COOH+R2COOH (R1、R2代表烃基)



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱性溶液中:Na+、Cl-、K+、SO42- | |
| D. | 在强酸性溶液中:K+、Fe2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从节能角度考虑,工业选择无水氯化镁为原料冶炼镁,不选择氧化镁 | |
| B. | 若电解熔融氯化镁时有少量水,镁可能与水蒸气反应 | |
| C. | 阳极可以用不活泼金属铜、银 | |
| D. | 用湿润的KI淀粉试纸可以检阳极产生的气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com