
 将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )
将烧喊吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解,以实现H2S转化为S的目的.下列判断错误的是( )| A. | 电解过程中阳极区发生如下反应:S2--2e-=S,(n-l)S+S2-=Sn2- | |
| B. | 电解时阴极的电极反应式:2H20+2e-═H2↑+20H- | |
| C. | 电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成Sn2-+2H+═nS↓+H2↑ | |
| D. | 该装置的离子交换膜为阳离子交换膜 |
分析 电解过程中阳极区发生氧化反应,得到硫单质,然后是硫单质和硫离子之间的反应;阴极上氢离子放电生成氢气,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S,句电解池的工作原理来回答.
解答 解:A、电解过程中阳极区发生氧化反应,得到硫单质,然后是硫单质和硫离子之间的反应,即S2--2e-=S,(n-l)S+S2-=Sn2-,故A正确;
B、电解过程中阴极上氢离子放电生成氢气,2H20+2e-═H2↑+20H-,故B正确;
C、电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故C错误;
D、为了实现H2S转化为S的目的,电解后阳极区离子为Sn2-,酸性条件下,生成S单质、H2S,所以该装置的离子交换膜为阳离子交换膜,故D正确.
故选C.
点评 本题以S为载体考查了可逆反应、氧化还原反应、电解原理等知识点,本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl中含有共价键,又全部由非金属元素组成,属于共价化合物 | |
| B. | 氮气和氦气都是非金属单质,都不存在化学键 | |
| C. | H2O2和Na2O2 都属于氧化物,两种物质中所含的化学键的类型完全相同 | |
| D. | KOH中既含有离子键也含有共价键,属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 乙酸和水、甲苯和水、己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
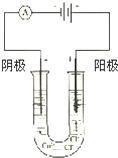 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
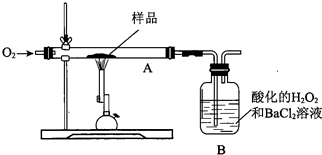
| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
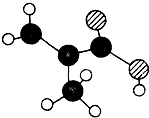 某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等):
某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等):
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com