
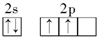
 b.
b.
分析 (1)根据能量最低原理,基态碳原子的价电子排布式为2s22p2;
(2)分子晶体的熔沸点较低,氯化铝的熔沸点较低,所以为分子晶体;
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
(3)计算B原子价层电子对数、孤电子对数,确定B原子杂化方式与空间构型;
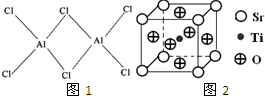
(4)利用均摊法计算晶胞中Sr、Ti、O原子数目,进而确定化学式.
解答 解:(1)根据能量最低原理,基态碳原子的价电子排布式为2s22p2,价电子排布图 ,
,
故答案为:a;a价电子排布使整个原子的能量最低;
(2)分子晶体的熔沸点较低,氯化铝的熔沸点较低,所以为分子晶体;
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,如图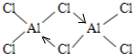 ,
,
故答案为:分子; ;
;
(3)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,所以采取sp3杂化,B原子没有孤电子对,为正四面体构型,
故答案为:sp3;正四面体;
(4)晶胞中Sr原子数目为8×1,Ti原子数目为1,O原子数目为6×$\frac{1}{2}$=3,故化学式为SrTiO3,
故答案为:SrTiO3.
点评 本题是对物质结构的考查,涉及核外电子排布、晶体类型与性质、配位键、杂化方式、空间构型、晶胞计算等,需要学生熟练掌握基础知识,难度中等.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | H与D | B. | CH3CH2OH与CH3COOH | ||
| C. | CH≡CH与C6H6 | D. | CH3CH2CH2CH3与 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
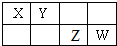 X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )
X、Y、Z、W是元素周期表中短周期元素,且原子序数依次递增,四种元素在元素周期表中的位置关系如图.四种元素的最高价含氧酸根离子一定能够水解的是( )| A. | X | B. | Y | C. | Z | D. | W |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取少量H2 | |
| B. |  分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  验证Na和水反应为放热效应 | |
| D. |  收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的气态氢化物的稳定性依次增强 | |
| B. | XZ2分子中δ键与π键个数之比为1:1 | |
| C. | 原子半径由大到小的顺序:W>Z>Y | |
| D. | 由Z、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g金属铁于足量的盐酸反应,转移电子数为0.2NA | |
| B. | 标准状况下,以任意比混合的H2、CO2的混合气体22.4L,所含分子数为NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,溶质的物质的量浓度为1mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 若负载为铅蓄电池,则在对铅蓄电池充电时与Cu极相连的一极发生还原反应. | |
| C. | 通空气时时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com