
 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )| A. | 298K 时,0.1mol•L-1HX 溶液中HX的电离度为1% | |
| B. | V=10mL时,同时微热溶液(忽略体积变化),$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大 | |
| C. | V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) | |
| D. | 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
分析 A.根据图知,常温下0.1mol/L的HX溶液的pH=4,溶液中c(H+)<c(HX),说明HX在水溶液中不完全电离,则HX为弱酸,电离度=$\frac{c(HX)(电离)}{c(HX)(总)}$×100%;
B.根据图知,常温下0.1mol/L的HY溶液的pH=1,溶液中c(H+)=c(HY),说明HY在水溶液中完全电离,为强酸,V=10mL时,HX溶液中溶质为等物质的量浓度的HX和NaX,HY溶液中溶质为等物质的量浓度的HY和NaY,同时微热溶液(忽略体积变化),升高温度促进HX电离,升高温度不影响HY电离,所以c(X-)增大、c(Y-)不变;
C.HX为弱酸,V=20mL 时,酸碱恰好完全反应生成NaX,NaX为强碱弱酸盐,其水溶液呈碱性,溶液中存在电荷守恒,结合电荷守恒判断离子浓度大小顺序;
D.恰好完全中和时NaX溶液呈碱性、NaY溶液呈中性,甲基橙的变色范围为3.1-4.4.
解答 解:A.根据图知,常温下0.1mol/L的HX溶液的pH=4,溶液中c(H+)<c(HX),说明HX在水溶液中不完全电离,则HX为弱酸,电离度=$\frac{c(HX)(电离)}{c(HX)(总)}$×100%=$\frac{1{0}^{-4}}{1{0}^{-1}}×100%$=0.1%,故A错误;
B.根据图知,常温下0.1mol/L的HY溶液的pH=1,溶液中c(H+)=c(HY),说明HY在水溶液中完全电离,为强酸,V=10mL时,HX溶液中溶质为等物质的量浓度的HX和NaX,HY溶液中溶质为等物质的量浓度的HY和NaY,同时微热溶液(忽略体积变化),升高温度促进HX电离,升高温度不影响HY电离,所以c(X-)增大、c(Y-)不变,所以$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大,故B正确;
C.HX为弱酸,V=20mL 时,酸碱恰好完全反应生成NaX,NaX为强碱弱酸盐,其水溶液呈碱性,则存在c(H+)<c(OH-),溶液中存在电荷守恒,结合电荷守恒得c(Na+)>c(X-),所以离子浓度大小顺序是c(Na+)>c(X-)>c(OH-)>c(H+),故C错误;
D.恰好完全中和时NaX溶液呈碱性、NaY溶液呈中性,甲基橙的变色范围为3.1-4.4,恰好完全中和时的pH不在甲基橙变色范围内,所以不能选取甲基橙代替酚酞,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高考重点知识点,也是学生学习难点,侧重考查学生图象分析判断及知识综合运用、灵活运用能力,正确理解电离度概念、溶液中存在的守恒是解本题关键,注意B选项的HX和NaOH混合溶液中根据混合溶液的pH确定HX电离程度和X-水解程度相对大小,从而确定升高温度溶液中c(X-)变化,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )
对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | B. | 该物质具有很高的熔、沸点 | ||
| C. | 该分子是非平面的八元环结构 | D. | 该物质与S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
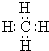 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时Pb为负极,此时溶液中的SO42-向Pb电极迁移 | |
| B. | 铅蓄电池电解CuCl2溶液,若制得2.24LCl2(标准状况),这时电池内消耗的H2SO4至少0.2mol | |
| C. | 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极上 | |
| D. | 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为6H2O+6e-═6OH-+3H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Cl-+2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.4mol•L-1•s-1 | B. | v(B)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.9 mol•L-1•s-1 | D. | v(D)=1 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com