
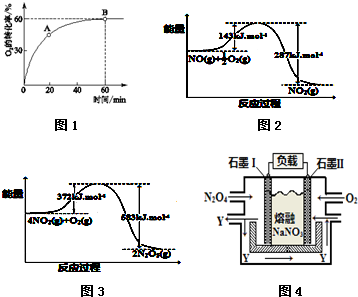
分析 (1)①A点没有达到平衡状态,正反应速率大于逆反应速率,而B点反应达到平衡状态,正逆反应速率相等;
②平衡时氧气的转化率是0.6,消耗氧气是0.6nmol,根据方程式可知同时消耗NO是1.2nmol,以此计算NO的平衡转化率;当达到B点后往容器中再以4:1 加入些NO和 O2,相当于增大压强,平衡向体积减小的正反应方向进行;
③到达B点后,反应达到平衡状态,则物质的浓度不再发生变化、平衡时正逆反应速率相等及衍生的物质的量不变
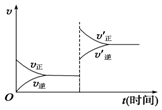
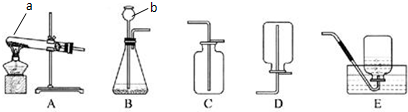
(2)根据图1和图2可知反应的热化学方程式分别是①NO(g)+$\frac{1}{2}$O2(g)=NO2(g)△H=143kJ/mol-287kJ/mol=-144kJ/mol,
②4NO2(g)+O2(g)=2N2O5(g)△H=372kJ/mol-583kJ/mol=-211kJ/mol,
由盖斯定律可知①×4+②即得到4NO(g)+3O2(g)=2N2O5(g);
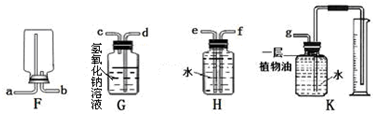
(3)氧气在正极通入,石墨Ⅱ是正极,石墨I是负极,N2O4失去电子转化为N2O5,以此来解答.
解答 解:(1)①A点没有达到平衡状态,正反应速率大于逆反应速率.B点反应达到平衡状态,正逆反应速率相等,因此A点的逆反应速率v逆 (O2)小于B点的正反应速率v正(O2),故答案为:小于;
②平衡时氧气的转化率是0.6,消耗氧气是0.6nmol,根据方程式可知同时消耗NO是1.2nmol,则NO的平衡转化率为$\frac{1.2nmol}{4nmol}$×100%=30%;当达到B点后往容器中再以4:1 加入些NO和 O2,相当于增大压强,平衡向体积减小的正反应方向进行,因此当达到新平衡时,则NO的百分含量小于B点NO的百分含量,
故答案为:30%;小于;
③到达B点后,反应达到平衡状态,则
A.物质的浓度不再发生变化,所以容器内气体颜色不再变化,故A正确;
B.平衡时正逆反应速率相等,则v正(NO)=2 v正(O2,故B正确;
C.平均相对分子质量是气体的质量与气体总物质的量的比值,正方应是体积减小的,所以气体平均摩尔质量在此条件下达到最大,故C正确;
D.气体的质量和容器的容积均不变,则容器内气体密度不再变化,故D正确;
故答案为:ABCD;
(2)根据图1和图2可知反应的热化学方程式分别是①NO(g)+$\frac{1}{2}$O2(g)=NO2(g)△H=143kJ/mol-287kJ/mol=-144kJ/mol,
②4NO2(g)+O2(g)=2N2O5(g)△H=372kJ/mol-583kJ/mol=-211kJ/mol,
由盖斯定律可知①×4+②即得到4NO(g)+3O2(g)=2N2O5(g)△H=-787kJ/mol,
故答案为:-787kJ/mol;
(3)氧气在正极通入,石墨Ⅱ是正极,石墨I是负极,N2O4失去电子转化为N2O5,电极反应式为N2O4+2NO3--2e-=2N2O5,
故答案为:N2O5;N2O4+2NO3--2e-=2N2O5.
点评 本题考查化学平衡的计算,为高频考点,把握平衡影响因素、盖斯定律应用、电极反应书写为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | Z、W中之一为气体,X、Y为非气体 | ||
| C. | X、Y、Z皆为气体,W为非气体 | D. | X、Y、Z、W皆为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Ag2SO4 | FeS | CuS | Ag2S | |
| Ksp | 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
| A. | 相同温度下,Ag2SO4、FeS、CuS饱和溶液中:c(Cu2+)>c(Fe2+)>c(Ag+) | |
| B. | 向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:S2-+Cu2+=CuS↓ | |
| C. | 浓度均为0.004mol•L-1的AgNO3和H2SO4溶液等体积混合后不能产生沉淀 | |
| D. | 向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com