
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中的空间构型为正四面体形 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
分析 依据价层电子对互斥理论可知,中心原子的价层电子对数=σ键电子对数+孤电子对数,据此判断杂化类型和分子的空间构型;若分子结构对称,正负电荷中心重叠,则为的非极性分子,据此分析.
解答 解:A.依据价层电子对互斥理论可知,CS2中C原子的价层电子对数=2+$\frac{1}{2}$(4-2×2)=2,为sp杂化,为直线形,由于结构对称属于非极性分子,故A错误;
B.由价层电子对互斥理论可知Cl03-中Cl原子的价层电子对数=3+$\frac{1}{2}$×(7+1-3×2)=4,为sp3杂化,由于含有1对孤电子对,所以Cl03-是三角锥形,故B错误;
C.SF6中S原子的价层电子对数=6+$\frac{1}{2}$×(6-6×1)=6,为sp3d2杂化,分子构型为正八面体,故C错误;
D.SiF4中Si原子的价层电子对数=4+$\frac{1}{2}$×(4-4×1)=4,为sp3杂化,SO32- 中S原子的价层电子对数=3+$\frac{1}{2}$×(6+2-3×2)=4,为sp3杂化,故D正确.
故选D.
点评 本题考查了杂化类型的判断和分子空间构型的判断,题目难度中等,注意掌握价层电子对互斥理论,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 由共价键形成的一定是共价化合物分子 | |
| D. | 只有非金属原子间才能形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、ClO-、Cl- | B. | H+、NH4+、Fe2+、NO3- | ||
| C. | Ag+、K+、Cl-、SO42- | D. | K+、AlO2-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
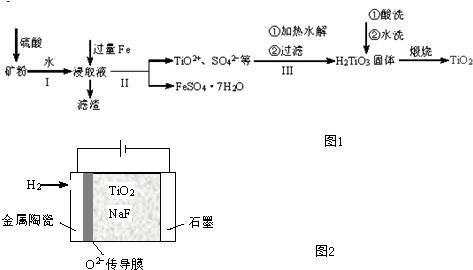
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

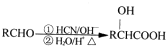
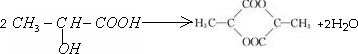 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为4的H2SO4、NH4Cl溶液中,水的电离程度相同 | |
| B. | 等pH的NaOH溶液与NH3•H2O 稀释后pH的变化如右图所示,则曲线I表示的是NaOH溶液的稀释 | |
| C. | 1mol/LNa2CO3溶液中存在:c(Na+)=2c(CO32- )+2c(HCO3-) | |
| D. | 向某温度的氨水中通入盐酸,则氨水的电离常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O.1molNa2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24LCl2含孤电子对的数目为0.2NA | |
| C. | PH=2的H2SO4溶液中含H+的数目为0.12NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=n | B. | pH=-lg n | C. | pH=14-lgn | D. | pH=lgn+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 转移的电子数是0.1NA | B. | 反应后液体质量减少1.6g | ||
| C. | 生成的气体中含有0.8mol中子 | D. | 生成气体的体积是1.12L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com