
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
(1)连二次硝酸中氮元素的化合价为 .
(2)常温下,用0.01molL﹣1的NaOH溶液滴定10mL001molL﹣1H2N2O2溶液,测得溶液PH与NaOH溶液体积的关系如图所示. 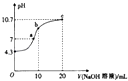
①写出H2N2O2在水溶液中的电离方程式: .
②c点时溶液中各离子浓度由大到小的顺序为 .
③b点时溶液中c(H2N2O2)(填“>”“<”或“=”,下同)c(N2O22﹣).
④a点时溶液中c(Na+)c(HN2O2﹣)+c(N2O22﹣).
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 ![]() = [已知Ksp(Ag2N2O2)=4.2×10﹣9 , Ksp(Ag2SO4)=1.4×10﹣5].
= [已知Ksp(Ag2N2O2)=4.2×10﹣9 , Ksp(Ag2SO4)=1.4×10﹣5].
【答案】
(1)+1
(2)H2N2O2?HN2O2﹣+H+;c(Na+)>c(N2O22﹣)>c(OH﹣)>c(HN2O2﹣)>c(H+);>;>
(3)3.0×10﹣4
【解析】解:(1)H2N2O2分子中H的化合价为+1,O元素的化合价为﹣2,设N元素的化合价为x,根据总化合价之和为0可知:2x+(+1)×2+(﹣2)×2=0,解得:x=1,即N元素的化合价为+1, 所以答案是:+1;(2)①根据图象可知,氢氧化钠溶液体积为0时,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸只要以第一步电离为主,则其电离方程式为:H2N2O2HN2O2﹣+H+ ,
所以答案是:H2N2O2HN2O2﹣+H+;②c点滴入20mL相同浓度的NaOH溶液,反应后溶质为Na2N2O2 , HN2O2﹣部分水解,溶液呈碱性,则:c(OH﹣)>c(H+),由于溶液中氢氧根离子还来自水的电离及HN2O2﹣的水解,则c(OH﹣)>c(HN2O2﹣),溶液中离子浓度大小为:c(Na+)>c(N2O22﹣)>c(OH﹣)>c(HN2O2﹣)>c(H+),
所以答案是:c(Na+)>c(N2O22﹣)>c(OH﹣)>c(HN2O2﹣)>c(H+);③c点溶质为NaHN2O2 , 溶液的pH>7,说明溶液显示碱性,则HN202﹣的水解程度大于其电离程度,所以c(H2N2O2)>c(N2O22﹣),
所以答案是:>;④根据图象可知,a点时溶液的pH=7,溶液呈中性,则c(OH﹣)=c(H+),根据电荷守恒可知c(Na+)=c(HN2O2﹣)+2c(N2O22﹣),所以c(Na+)>c(HN2O2﹣)+c(N2O22﹣),
所以答案是:>;(3)当两种沉淀共存时, ![]() =
= ![]() =
= ![]() =3.0×10﹣4 ,
=3.0×10﹣4 ,
所以答案是:3.0×10﹣4 .


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体.
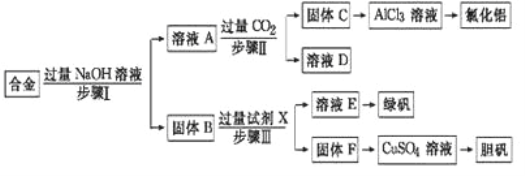
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是_________.实验室中进行该操作时,用到的玻璃仪器有烧杯、_______.
(2)溶液A中的阴离子主要有_________;试剂X是_______.
(3)向溶液A中通入过量CO2气体生成固体C的离子方程式为____________.
(4)从环境保护角度考虑,用固体F制备CuSO4溶液的化学方程式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最新开发的一种新原理二次电池的能量密度是现行锂电池的7倍,该电池结构如图所示,下列有关说法正确的是( ) 
A.电池放电时Li+向负极移动
B.电池放电时,正极的电极反应式为:2Li++Li2O2+2e﹣═2Li2O
C.电池充电时,Li极应与外电源的正极相连
D.电池系统内进入二氧化碳及水对电池性能不会产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实的解释中错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸具有吸水性
C. 常温下能够用铝罐储存浓硫酸,是因为浓硫酸的强氧化性可使铝发生钝化
D. 反应:C+2H2SO4(浓)![]() CO2↑+2H2O+2SO2↑中,H2SO4既体现酸性又体现了强氧化性
CO2↑+2H2O+2SO2↑中,H2SO4既体现酸性又体现了强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA
B.18 g D2O中含有的质子数目为10 NA
C.标准状况下,22.4 L二氯甲烷的分子数约为NA
D.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:其中正确的是( )
①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质B的浓度为0.7molL﹣1
④2s末,物质A的转化率为70%
A.①④
B.①③
C.②④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的分子量为
A. 28 B. 60 C. 32 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以大量共存且溶液是无色的离子组是( )
A. H+、Na+、NO3-、Cu2+B. Ba2+、Mg2+、Cl-、SO42-
C. K+、Mg2+、NO3-、SO42-D. K+、Mg2+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,它易溶于水,遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图。
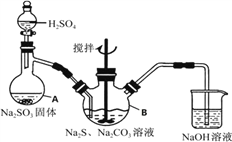
实验具体操作步骤为:
①打开分液漏斗使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
(1)写出仪器A的名称____。
(2)写出A中发生反应的化学方程式____。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,该反应的离子方程式为____。
(5) 为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下图装置进行实验。
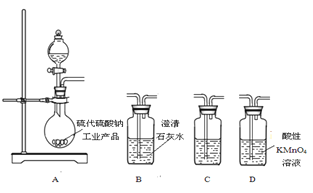
①实验装置的连接顺序依次是____(填装置的字母代号),装置C中的试剂为____。
②能证明固体中含有碳酸钠的实验现象是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com