
 合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡.
合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡.| 3 |
| 2 |
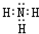 ,N原子的最外层电子排布的轨道表示式为:
,N原子的最外层电子排布的轨道表示式为: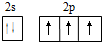 ,
,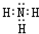 ;
; ;
;| 3 |
| 2 |
| 3 |
| 2 |
| 0.1mol/L |
| 4min |
| ||
| 高温高压 |
| ||
| 高温高压 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
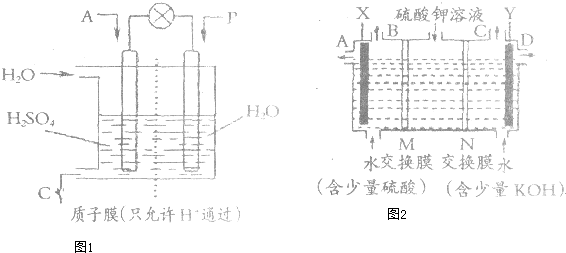
查看答案和解析>>
科目:高中化学 来源: 题型:
A、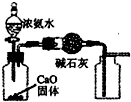 如图用装置制取并收集干燥纯净的NH3 |
B、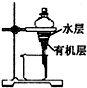 如图用装置分离苯萃取碘水后已分层的有机层和水层 |
C、 如图用装置配制一定的物质的量浓度的稀硫酸 |
D、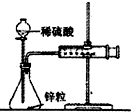 如图用装置测定锌与稀硫酸反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器底部没有固体,溶液中仅有Fe2+ |
| B、容器底部固体有铜和铁,溶液中只有Fe2+ |
| C、容器底部固体为铜,溶液中可能有Cu2+和Fe2+ |
| D、容器底部固体为铁粉,溶液中有Cu2+和Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 物质 | AlF3 | AlCl3 | BCl3 | NCl3 |
| 熔点/℃ | 1291 | 160 | -107 | -40 |
| A、BCl3、NCl3分子中各原子最外层都满足8电子稳定结构 |
| B、因为键长B-F<B-Cl,故BF3的熔点高于BCl3 |
| C、AlF3、AlCl3都是强电解质,但晶体类型不同 |
| D、BCl3为平面正三角形分子,故它是由极性键构成的非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com