
分析 废旧锂离子电池的正极材料主要含有LiCoO2(也表示为:Li20•Co203)及少量Fe、Al等,向样品中加入稀硫酸、SO2,发生的反应有2LiCoO2+2H2SO4+SO2=Li2SO4+2CoSO4+2H2O、Fe+H2SO4=FeSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑,然后向溶液中通入空气,Fe2+被氧化生成Fe3+,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,向溶液中加入NaOH,将Fe3+转化为Fe(OH)3沉淀,过滤后溶液再加入NaOH溶液,发生的离子反应为Co2++2OH-=Co(OH)2沉淀,过滤后向滤液中加入Na2CO3,得到沉淀Li2CO3,
(1)“酸溶、还原”步骤中被还原的元素为Co元素;
Fe3+用KSCN溶液检验;
(2)Fe2+不稳定,易被空气氧化生成Fe3+;“除铁”步骤中,pH不宜过高,其目的是确保Fe3+沉淀而A13+不沉淀,而在“沉钴”步骤中需加人过量的NaOH溶液,NaOH能溶解Al(OH)3;
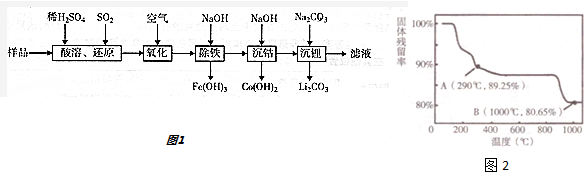
(3)根据质量守恒定律,在变化过程中,Co的质量没有变,通过题给数据看,在1000℃是Co(OH)2完全分解,则产物CoO;
反应前后Co元素位于固体中,290℃固体残留率为89.25%,假设原来固体质量为93g,其物质的量为1mol,
则n(Co)=n[Co(OH)2]=1mol,反应后固体质量减少质量为水,m(H2O)=93g×(1-89.25%),剩余固体中n(O)=2mol-$\frac{93g×(1-89.25%)}{18g/mol}$,
所以n(Co):n(O)=1mol:[2mol-$\frac{93g×(1-89.25%)}{18g/mol}$]=2:3,所以残留固体成分为Co2O3,根据反应物和生成物及反应条件书写方程式.
解答 解:废旧锂离子电池的正极材料主要含有LiCoO2(也表示为:Li20•Co203)及少量Fe、Al等,向样品中加入稀硫酸、SO2,发生的反应有2LiCoO2+2H2SO4+SO2=Li2SO4+2CoSO4+2H2O、Fe+H2SO4=FeSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑,然后向溶液中通入空气,Fe2+被氧化生成Fe3+,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,向溶液中加入NaOH,将Fe3+转化为Fe(OH)3沉淀,过滤后溶液再加入NaOH溶液,发生的离子反应为Co2++2OH-=Co(OH)2沉淀,过滤后向滤液中加入Na2CO3,得到沉淀Li2CO3,
(1)“酸溶、还原”步骤中被还原的元素为Co元素;
Fe3+用KSCN溶液检验,其检验方法为:取“废铁”后的滤液2-3mL,滴加KSCN溶液,若溶液不变红色,则说明上述滤液中不含铁离子,否则含有铁离子,
故答案为:Co;取“废铁”后的滤液2-3mL,滴加KSCN溶液,若溶液不变红色,则说明上述滤液中不含铁离子,否则含有铁离子;
(2)Fe2+不稳定,易被空气氧化生成Fe3+,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,“除铁”步骤中,pH不宜过高,其目的是确保Fe3+沉淀而A13+不沉淀,而在“沉钴”步骤中需加人过量的NaOH溶液,NaOH能溶解Al(OH)3,且确保Co2+沉淀,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;确保Co2+沉淀,并将Al3+转化为AlO2-从而避免沉淀;
(3)根据质量守恒定律,在变化过程中,Co的质量没有变,通过题给数据看,在1000℃是Co(OH)2完全分解,则产物CoO;
反应前后Co元素位于固体中,290℃固体残留率为89.25%,假设原来固体质量为93g,其物质的量为1mol,
则n(Co)=n[Co(OH)2]=1mol,反应后固体质量减少质量为水,m(H2O)=93g×(1-89.25%),剩余固体中n(O)=2mol-$\frac{93g×(1-89.25%)}{18g/mol}$,
所以n(Co):n(O)=1mol:[2mol-$\frac{93g×(1-89.25%)}{18g/mol}$]=2:3,所以残留固体成分为Co2O3,根据反应物和生成物及反应条件书写方程式为4Co(OH)2+O2$\frac{\underline{\;290℃\;}}{\;}$2Co2O3+4H2O,
故答案为:CoO;4Co(OH)2+O2$\frac{\underline{\;290℃\;}}{\;}$2Co2O3+4H2O.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析计算能力,明确流程图中各个步骤发生的反应或操作目的是解本题关键,难点是(3)题计算,根据反应前后Co原子守恒进行计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,说明产物中含+2价铁元素,若KMnO4溶液不褪色或红色不变浅,说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶液 | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )| A. | Al粉作为氧化剂 | B. | Al被氧化 | C. | Al发生还原反应 | D. | Al得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 尿素[CO(NH2)2]是一种有机物 | D. | 聚丙烯的化学式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| a转化为b | a转化为c | c转化为b | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com