
【题目】已知某种有机物A的质谱图和红外光谱图如图,以下说法正确的是( )
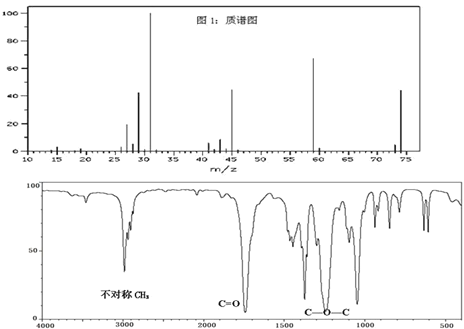
A.由质谱图可知,有机物A的摩尔质量为74
B.由红外光谱可知,有机物A的分子式C3H6O2
C.有机物A的核磁共振氢谱图中有3种吸收峰,峰面积之比为1:2:3
D.有机物A的名称为甲酸乙酯,官能团为酯基
【答案】B
【解析】
通过质谱图易知有机物A的相对分子质量为74,红外光谱显示该分子中存在两个不对称的—CH3,那么C=O和C—O—C合起来为一个酯基,该分子的结构简式为CH3COOCH3,其相对分子质量恰好为74,猜测合理。
A.质谱图中谱线横坐标最大值就是该有机物的相对分子质量,所以有机物A的摩尔质量为74g/mol,A项错误;
B.由红外光谱可知,有机物A的结构简式为CH3COOCH3,则分子式为C3H6O2,B项正确;
C.结合该分子的结构简式为CH3COOCH3,有机物A的核磁共振氢谱图中有2种吸收峰,峰面积之比为1:1,C项错误;
D.有机物A的名称为乙酸甲酯,官能团为酯基,D项错误;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O下列说法正确的是
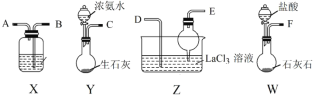
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.实验开始时应先打开W中分液漏斗的旋转活塞
D.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将2019年度诺贝尔化学奖授予美国JohnBGoodenough教授、M.stanleyWhittlingham教授和日本化学家AkiraYoshino,以表彰其在锂离子电池的发展方面作出的贡献。
(1)基态锂原子核外能量最高的电子所处能级的电子云轮廓图的形状为___;基态磷原子第一电离能比硫的___ (填“大”或“小”),原因是___。
(2)实室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;
(3)磷酸(H3PO4)和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为___;亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
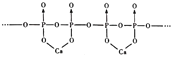
由图推知该多磷酸钙盐的通式为__(用n表示重复单元数)
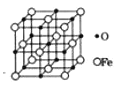
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__;Fe2+与O2-最短核间距为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山豆根查尔酮具有清热解毒的作用。下列说法错误的是( )
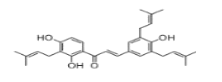
A.它的化学式为C30H34O4。
B.分子中所有的C原子可能共面。
C.1mol山豆根查尔酮最多消耗NaOH、H2的物质的量分别为3mol、11mol。
D.可以用浓溴水检验山豆根查尔酮的存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl和Na+,在两电极板形成电势差,进而在外部产生电流。下列关于该电池的说法正确的是( )
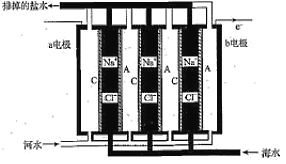
A.a电极为电池的正极,电极反应为2H++2e═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知:甲醇分解反应:CH3OH(g)![]() CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)
CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
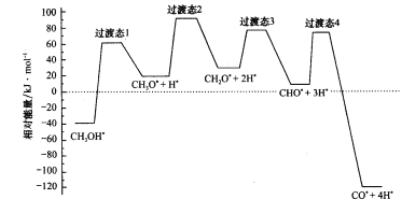
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为_________________________。
(3)在0.1MPa下,将总进料量1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
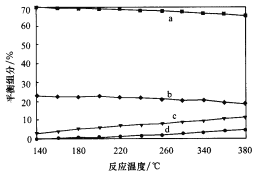
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是__________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,试解释a的含量约是c的含量3倍的原因__________。
(4)297 K时,向密闭容器Ⅰ(体积为4L)和Ⅱ(体积为8L)中分别充入下列物质发生反应,
编号 | CO(mol) | H2(mol) | CH3OH(mol) |
Ⅰ | 4 | a | 0 |
Ⅱ | 4 | 4 | 4 |
达平衡时两个容器中c(H2)相等且c(H2)=0.5mol/L。则
①a=_____________。
②该温度时,Ⅰ中反应的K=___________。
③Ⅱ中按表格数据充入反应物此时反应的方向__________(填“正向进行”、“平衡”或“逆向进行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为 _______(MnO4-被还原为Mn2+)
(2)甲烷硫磺法制取CS2的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H。
CS2(g)+2H2S(g) △H。
① 在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_______(填字母)
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H—S键数目相等
②已知下列键能数据:
共价键 | C—H | S=S | C=S | H—S |
律能/kJmol-1 | 411 | 425 | 573 | 363 |
该反应的△H _______kJmol-1
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g) +2H2S(g)CS2(g) + 4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
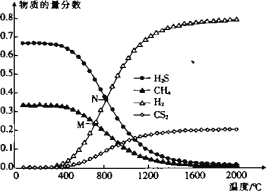
①该反应△H _______(填“>”或“<”)0。
②M点,H2S的平衡转化率为_______,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是_______(列举一条)。
③N点,平衡分压p(CS2)=_______MPa,对应温度下,该反应的KP =_______(MPa)2。(KP为以分压表示的平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
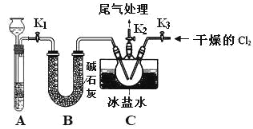
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com