
【题目】下列有关钠的物理性质的叙述中正确的是
①银白色金属 ②质软,可以用小刀切割
③熔点低于100℃④密度比水小
⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应),请回答下列问题:

(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。
例如,石油分馏产物之一的十六烧烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______,乙的结构简式为________。
4乙,则甲的分子式为______,乙的结构简式为________。
(2)B装置中的实验现象可能是______,写出反应的化学方程式:______ , 其反应类型是_________。
(3)C装置中可观察到的现象是_______,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_______ (填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由:_________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是______(选填字母,下同);除去甲烷中乙烯的方法是_______。
A.气体通入水中 B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 LC.1.8 LD.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:

(1)A是一种遇到碘单质能变蓝的多糖,A的分子式是_______________。
(2)物质B、C都能在加热条件下与新制的氢氧化铜反应产生砖红色沉淀,但不能发生水解反应,B中官能团的名称为____________,写出反应②的化学方程式___________________。
(3)下图是实验室通过反应①制取少量E的装置图。

实验时,加热前试管a中三种化学试剂的加入顺序依次为__________________(填名称),其中浓硫酸的作用是____________,写出试管a中生成E的化学反应方程式___________________。
(4)上述流程中C2H3Cl的结构简式____________。
(5)上述流程中标号①至④的反应中,与下列反应属同一反应类型的有______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.3 mol·L-1酒精溶液的密度为ρ1 g·mL-1,0.1 mol·L-1酒精溶液的密度为ρ2 g·mL-1,其中ρ1<ρ2,若将上述两溶液等质量混合,(忽略混合时溶液体积的变化)所得酒精溶液的物质的量浓度是 ( )
A. 等于0.2 mol·L-1 B. 大于0.2 mol·L-1
C. 小于0.2 mol·L-1 D. 无法估算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池和电解池的叙述中,正确的是
A.纯锌与稀硫酸的反应比Zn-Cu合金与稀硫酸的反应更快
B.钢铁发生吸氧腐蚀时,负极的反应式为:Fe-3e-=Fe3+
C.在铁制容器上镀铜时,铁制容器连接外接电源的正极
D.电解精炼铜时,阴极的电极反应为:Cu2+ + 2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解已广泛应用于金属冶炼、污水的处理等工业。
(1)新型的钛基纳米PbO2电极材料制备:在钛板上先形成一层铝膜,在草酸溶液中作阳极氧化为氧化铝同时形成孔洞,再在Pb(NO3)2溶液中浸泡电解形成纳米PbO2,用氢氧化钠溶液浸泡除去多余的氧化铝,获得钛基纳米PbO2电极。
①钛基板打磨后用丙酮浸泡,再用水冲洗,用丙酮浸泡的作用是 。
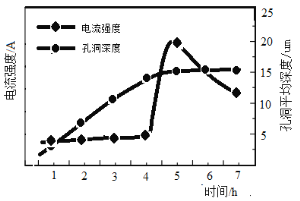
②阳极氧化时溶液中电流强度和基板孔洞深度随时间变化如下图所示,氧化的终点电流突然增加的原因是 。电极氧化成孔洞时温度需严格控制在8℃左右,温度不宜过高的原因是 。
③电解形成纳米PbO2时阳极电极反应式为 。工业上可以用Na2S2O8溶液氧化Pb(NO3)2制备PbO2,其离子方程式为 。
(2)PbO2做阳极电解处理污水
①用PbO2材料做阳极处理污水的效果明显优于石墨电极,其原因可能是 。
②某小组用自己制作的钛基纳米PbO2电极电解处理污水,发现污水澄清效果优于购买的标准钛基纳米PbO2电极。此钛基纳米PbO2电极的EDX能图谱信息如下图,其去污效果好的原因可能是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________
(用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如右图所示。

①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________;
=6,则FexOy的化学式为____________;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4molCO2和8molH2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________;
KA、KB、KC三者之间的大小关系为_____________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3-;反应NH4++HCO3+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。
NH3·H2O+H2CO3的平衡常数K=__________。
(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com