
 ¼×Ķ锢Ņ»Ńõ»ÆĢ¼ŗĶĒāĘų”¢¼×“¼µČ¼ČŹĒÖŲŅŖµÄČ¼ĮĻŅ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®ŅŃÖŖ£ŗ
¼×Ķ锢Ņ»Ńõ»ÆĢ¼ŗĶĒāĘų”¢¼×“¼µČ¼ČŹĒÖŲŅŖµÄČ¼ĮĻŅ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®ŅŃÖŖ£ŗ| »Æѧ¼ü | C-C | C-H | H-H | C-O | C”ŌO | H-O |
| ¼üÄÜ £ØkJ•mol-1£© | 348 | 413 | 436 | 358 | 1072 | 463 |
·ÖĪö £Ø1£©ŅĄ¾ŻČČ»Æѧ·½³ĢŹ½ŗĶøĒĖ¹¶ØĀɼĘĖćµĆµ½¼×Ķé²»ĶźČ«Č¼ÉÕÉś³ÉŅ»Ńõ»ÆĢ¼ŗĶŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½£»
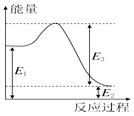
£Ø2£©·“Ó¦ČČÖø·“Ó¦Īļ×ÜÄÜĮæ¼õČ„Éś³ÉĪļ×ÜÄÜĮ棬¹Ź£©”÷H=E2-E1£»
£Ø3£©ŅĄ¾Ż»Æѧ·“Ó¦ģŹ±ä=·“Ó¦Īļ¼üÄÜ×ÜŗĶ-Éś³ÉĪļ¼üÄÜ×ÜŗĶ¼ĘĖć£¬±ź×¢ĪļÖŹ¾Ū¼ÆדĢ¬ŗĶ¶ŌÓ¦·“Ó¦µÄģŹ±äŠ“³öČČ»Æѧ·½³ĢŹ½£»ÕāŹĒŅ»øöæÉÄę·“Ó¦²»ÄÜ100%ĶźČ«×Ŗ»Æ£¬¹Ź·Å³öµÄČČĮæĪŖQkJ£¼|a|£¬¾Ż“Ė½ųŠŠ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©¢Ł2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H1=-571.6kJ•mol-1
¢ŚCH4£Øg£©+$\frac{1}{2}$O2£Øg£©ØTCO£Øg£©+2H2£Øg£©”÷H2=-36kJ•mol-1
¢ŪCH4£Øg£©+H2O£Øg£©ØTCO£Øg£©+3H2£Øg£©”÷H3=+216kJ•mol
ŅĄ¾ŻøĒĖ¹¶ØĀÉ¢Ł+¢ŚµĆµ½¼×Ķé²»ĶźČ«Č¼ÉÕÉś³ÉŅ»Ńõ»ÆĢ¼ŗĶŅŗĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗCH4£Øg£©+$\frac{3}{2}$O2£Øg£©ØTCO£Øg£©+2H2O£Øl£©”÷H=-607.6 kJ•mol-1£»ÓÉ·“Ó¦¢ŚŗĶ¢Ū”÷HµÄŹżÖµæÉÖŖ£¬µ±O2ÓėH2OµÄĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ1Ź±£¬·“Ó¦¢ŚÓė¢Ū·Å³ö£Ø»ņĪüŹÕ£©µÄČČĮæĻąµČ£¬O2µÄĢå»ż·ÖŹżĪŖx=0.75£»
¹Ź“š°øĪŖ£ŗCH4£Øg£©+$\frac{3}{2}$O2£Øg£©ØTCO£Øg£©+2H2O£Øl£©”÷H=-607.6 kJ•mol-1£»
£Ø2£©·“Ó¦ČČÖø·“Ó¦Īļ×ÜÄÜĮæ¼õČ„Éś³ÉĪļ×ÜÄÜĮ棬¹Ź”÷H=E2-E1=-36kJ£¬¼“E1-E2=36kJ£¬
¹Ź“š°øĪŖ£ŗC£»
£Ø3£©CO£Øg£©+2H2£Øg£©?CH3OH £Øg£©£¬·“Ó¦µÄģŹ±äæÉŅŌøł¾Ż·“Ó¦ĪļµÄ×ܼüÄÜŗĶÉś³ÉĪļµÄ×ܼüÄܼĘĖćµĆµ½£¬ģŹ±ä=·“Ó¦Īļ×ܼüÄÜÖ®ŗĶ-Éś³ÉĪļ×ܼüÄÜÖ®ŗĶ£¬ŅĄ¾ŻĶ¼±ķĢį¹©µÄ»Æѧ¼üµÄ¼üÄܼĘĖćµĆµ½£¬”÷H1ØT1072KJ/mol+2”Į436KJ/mol-£Ø3”Į413KJ/mol+358KJ/mol+463KJ/mol£©=-116 kJ•mol-1£¬ČČ»Æѧ·½³ĢŹ½CO£Øg£©+2H2£Øg£©?CH3OH £Øg£©”÷H=-116 kJ•mol-1£¬¹Źa=-116£»ÕāŹĒŅ»øöæÉÄę·“Ó¦²»ÄÜ100%ĶźČ«×Ŗ»Æ£¬¹Ź·Å³öµÄČČĮæĪŖQkJ£¼|a|£¬
¹Ź“š°øĪŖ£ŗ-116£»£¼£®
µćĘĄ ±¾ĢāÉę¼°»Æѧ·“Ó¦ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£¬ŅŌ¼°ģŹ±äŗĶ»Æѧ¼ü¼üÄÜÖ®¼äµÄ¹ŲĻµ£¬æÉÄę·“Ó¦²»ÄÜ100%ĶźČ«×Ŗ»ÆµÄĢŲµć£¬±¾ĢāÄѶČÖŠµČ£®


 ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚµķ·ŪČÜŅŗÖŠ¼ÓČėĻ”ĮņĖį¼ÓČČŅ»¶ĪŹ±¼äŗó£¬ŌŁµĪ¼ÓŅų°±ČÜŅŗ¼ģŃéµķ·ŪµÄĖ®½ā²śĪļ | |
| B£® | ²ā¶ØÖŠŗĶ·“Ó¦µÄ·“Ó¦ČČŹ±£¬½«¼īČÜŅŗ»ŗĀżµ¹ČėĖįČÜŅŗÖŠ | |
| C£® | ÓĆÕōĮóĖ®ŹŖČópHŹŌÖ½ŗó²ā¶ØĮņĖįÄĘČÜŅŗµÄpH | |
| D£® | ÓĆĖį¼īÖŠŗĶµĪ¶Ø·Ø²ā¶ØĪ“ÖŖÅØ¶ČµÄ¼īŅŗŹ±£¬ŌŚ×¶ŠĪĘæÖŠ¼ÓČė2-3mL·ÓĢŖŹŌŅŗ×÷ÖøŹ¾¼Į |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
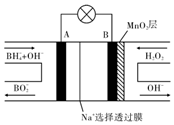 ŠĀŠĶ$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$Č¼ĮĻµē³Ų£ØDBFC£©µÄ½į¹¹ČēĶ¼ĖłŹ¾£¬øƵē³Ų×Ü·“Ó¦·½³ĢŹ½£ŗNaBH4+4H2O2ØTNaBO2+6H2O£¬ÓŠ¹ŲµÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ŠĀŠĶ$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$Č¼ĮĻµē³Ų£ØDBFC£©µÄ½į¹¹ČēĶ¼ĖłŹ¾£¬øƵē³Ų×Ü·“Ó¦·½³ĢŹ½£ŗNaBH4+4H2O2ØTNaBO2+6H2O£¬ÓŠ¹ŲµÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ÄÉĆ×MnO2²ćµÄ×÷ÓĆŹĒĢįøßŌµē³ŲµÄ¹¤×÷Š§ĀŹ | |
| B£® | ·Åµē¹ż³ĢÖŠ£¬Na+“ÓB¼«ĒųŅĘĻņA¼«Ēų | |
| C£® | µē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ£ŗBH4+8OH--8eŅ»ØTBO2-+6H2O | |
| D£® | ŌŚµē³Ų·“Ó¦ÖŠ£¬ĆæĻūŗÄ1L 1mol/L H2O2ČÜŅŗ£¬ĄķĀŪÉĻĮ÷¹żµēĀ·ÖŠµÄµē×ÓĪŖ2 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·Ö×ÓŹ½ĪŖC5H12µÄÓŠ»śĪļÓŠČżÖÖ£¬ĖüĆĒ»„ĪŖĶ¬ĻµĪļ | |
| B£® | C4H8C12ÓŠ9ÖÖĶ¬·ÖŅģ¹¹Ģå£Ø²»æ¼ĀĒĮ¢ĢåŅģ¹¹£© | |
| C£® | ŹÆĄÆÓĶ”¢±½”¢ĖÄ·śŅŅĻ©¶¼²»ÄÜŹ¹äåĖ®ĶŹÉ« | |
| D£® | µČĪļÖŹµÄĮæµÄ¼×ĶéÓėĀČĘų·“Ó¦ŗóĢå»ż±£³Ö²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹÆÓĶ·ÖĮóŹĒĪļĄķ±ä»Æ£¬æÉ»ńµĆĘūÓĶ”¢ĆŗÓĶ”¢²ńÓĶµČ²śĘ· | |
| B£® | C4H9Cl”¢C4H8Cl2µÄĶ¬·ÖŅģ¹¹ĢåÖÖĄą·Ö±šÓŠ4ÖÖ”¢9Ö֣ز»ŗ¬Į¢ĢåŅģ¹¹£© | |
| C£® | µķ·ŪŗĶĻĖĪ¬ĖŲĖ®½āµÄ×īÖÕ²śĪļ²»Ķ¬ | |
| D£® | ÓÉŅŅĖįÉś³ÉŅŅĖįŅŅõ„ŹōÓŚČ”“ś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
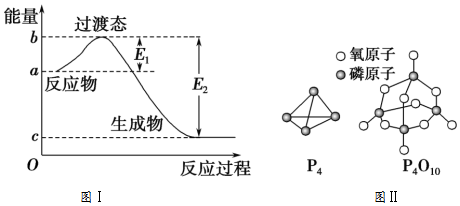
| »Æѧ¼ü | P-P | P-O | OØTO | PØTO |
| ¼üÄÜ/£ØkJ/mol£© | a | b | c | x |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹čŹĒĒ×ŃõŌŖĖŲ£¬ŌŚ×ŌČ»½ēÖŠŅŌ»ÆŗĻĢ¬“ęŌŚ | |
| B£® | ¹čŹĒ¹¹³ÉæóĪļŗĶŃŅŹÆµÄÖ÷ŅŖŌŖĖŲ£¬¹čŌŚµŲæĒÖŠµÄŗ¬ĮæŌŚĖłÓŠŌŖĖŲÖŠ¾ÓµŚŅ»Ī» | |
| C£® | ¹čµÄ»īĘĆŠŌ±ČĢ¼Ē棬ֻӊŌŚøßĪĀĻĀ²ÅÄÜøśĒāĘųĘš»ÆŗĻ·“Ó¦ | |
| D£® | ¶žŃõ»Æ¹čŌŚµē×Ó¹¤ŅµÖŠ£¬ŹĒÖŲŅŖµÄ°ėµ¼Ģå²ÄĮĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 100 mL 1 mol/LµÄFeCl3ČÜŅŗĶźČ«Éś³ÉFe£ØOH£©3½ŗĢ壬Ęä½ŗĮ£ŹżÄæĪŖ0.1 NA | |
| B£® | 7.8 gNa2O2ÖŠŗ¬ÓŠµÄĄė×Ó×ÜŹżÄæĪŖ0.4 NA | |
| C£® | ±ź×¼×“æöĻĀ£¬44.8 L HFĖłŗ¬·Ö×ÓŹżĪŖ2 NA | |
| D£® | ±ź×¼×“æöĻĀ£¬80 gSO3ÖŠĖłŗ¬µÄŌ×ÓŹżĪŖ4 NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×ÓŠņŹż | B£® | ŌŖĖŲŠŌÖŹ | C£® | Ō×Ó°ė¾¶ | D£® | »ÆŗĻ¼Ū |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com