
| A. | R2+>X2+>Z2+>Y2+ | B. | X2+>R2+>Y2+>Z2+ | C. | Y2+>Z2+>R2+>X2+ | D. | Z2+>X2+>R2+>Y2+ |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5×6.02×1023个 | |
| B. | 36.5g氯化氢中含有6.02×1023个氢离子 | |
| C. | 7.8gNa2O2与足量的水反应,转移的电子数为0.2×6.02×1023 | |
| D. | 标准状况下,2.24L CO2和SO2混合物中所含有的原子数为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性最强的元素,其最高价氧化物对应水化物的酸性最强 | |
| B. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| C. | 同一主族元素的氢化物,相对分子质贤越大,它的沸点一定越高 | |
| D. | 在周期表中,主族序数都等于该族元素的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子的比例模型: | B. | HF的电子式:H:F | ||
| C. | Cl-离子的结构示意图: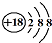 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有七个横行,也是七个周期 | |
| B. | 元素周期表有十八个纵行,也是十八个族 | |
| C. | 表中所含元素种类最少的周期是第一周期 | |
| D. | 表中所含元素种类最多的族是ⅢB族 |
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第二次周考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.硫酸铁和高铁酸钾的净水原理相同
B.镧镍合金能大量吸收氢气形成金属氢化物,可作储氢材料
C.氢氧化钙是一种弱电解质
D.硅酸胶体中逐渐加入氢氧化钠溶液中,先有沉淀生成再看到沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可与甲苯发生苯环上的取代反应 | |
| B. | 苯酚钠溶液中通入CO2后,溶液由澄清变浑浊,能证明苯酚具有弱酸性 | |
| C. | 光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 | |
| D. | 苯不能使KMnO4酸性溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com