
【题目】下列有关钠的叙述正确的是( )
A. 钠是银白色金属,硬度很大 B. 钠在空气中燃烧生成氧化钠
C. 金属钠的熔点很高 D. 金属钠可以保存在煤油中
科目:高中化学 来源: 题型:
【题目】立方烷( ![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物Ⅰ的一种合成路线: 
回答下列问题:
(1)C的结构简式为 , E的结构简式为 .
(2)③的反应类型为
(3)化合物A可由环戊烷经三步反应合成: 
反应1的试剂与条件为;
反应2的化学方程式为;
反应3可用的试剂为 .
(4)在I的合成路线中,互为同分异构体的化合物是(填化合物代号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A. H2SO4的摩尔质量是98
B. 2mol NO和2mol N2含分子数相同
C. 1mol Cl2的质量是71g
D. 标准状况下1mol O2与1mol H2气体所占的体积都约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度最大的是 ( )
A. 1mol/L NaCl溶液 B. 2mol/L CaCl2溶液 C. 3mol/L KCl溶液 D. 1mol/L FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 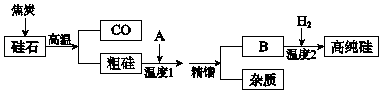
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙,TiCl4是生产金属钛的原料.
(1)工业上主要用TiO2氯化的方法来制取TiCl4
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),写出实验室用二氧化锰与浓盐酸反应制取Cl2的离子方程式 .
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4 , 从化学平衡的角度解释此方法能顺利制取TiCl4的原因 .
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4 , 装置如图1所示: 
如表是有关物质的性质:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | ﹣23 | 76.8 | 与TiCl4互溶 |
TiCl4 | ﹣25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是 .
②本实验中仪器a采用题给的加热方式的突出优点是 .
③B中CCl4与TiO2发生反应的化学方程式是 .
④欲分离C装置中的TiCl4 , 应采用的实验操作为(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,若混合溶液中Ba( OH)2和2NaOH的物质的量之比为1:1,则b点溶液中溶质主要成分的化学式为 , 从b点到c点,沉淀减少过程中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳.而氢气和氨气都被认为是无碳无污染的清洁能源. 
(1)某些合金可用于储存于氢,金属储氢的原理克表示为M+xH2═MH2x(M表示某种合金).如图1表示温度分别为T1、T2且T1<T2时最大吸氢量与氢气压强的关系.则该反应的△H0(填“>”或“<”)
(2)氨在氧气中燃烧,生成水和一种空气组成成分的单质.已知:N2(g)+3H2(g)2NH3(g)△H=﹣92KJmol﹣1及H2的燃烧热为286kJmol﹣1;试写出氨在氧气中燃烧生成液态水的热化学方程式: .
(3)在一定条件下,将1molN2和3molH2混合与一个10L的容积不变的密闭容器中发生反应,5分钟后达到平衡,平衡时氨的体积分数为25%.
①反应的平衡常数表达式为;
②反应开始到平衡时H2的消耗速率v(H2)=;
③能判断该反应是否达到化学平衡状态的依据是;
a 容器中压强不变 b.混合气体的密度不变
c.3v(H2)=2v(NH3) d.c(N2):c(H2):c(NH3)=1:3:2
④对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是;
a 选用更高效的催化剂 b 升高温度c 及时分离出氨气 d 增加H2的浓度
⑤如今采用SCY陶瓷固体电解质的电化学合成氨装置(如图2),该装置用可以传导质子的固态物质作为介质.电池总反应为N2(g)+3H2(g)2NH3(g),那么该电解池阴极反应式为 , 当阳极失去0.6mol电子时,阴极产生的气体在标准状态下的体积为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com