
【题目】某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的原因是 ( )
①用量筒取浓硫酸时,俯视读数;②量筒中浓硫酸全部转移到烧杯中稀释,再转移到100mL容量瓶中,烧杯未洗涤;③用玻璃棒引流将烧杯中溶液转移至容量瓶中,有溶液流到了容量瓶外面;④用胶头滴管加蒸馏水时,不是逐滴加入,因而使液面超过了刻度线,他立即用滴管吸去多余的水,使溶液凹面刚好和刻度线相切。
A. ②③④ B. ③④
C. ①②③ D. ①②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,等体积混合0.1mol/L的HCl溶液和0.06mol/L的Ba(OH)2溶液后,溶液的pH值等于( )
A.2.0 B.12.3 C.1.7 D.12.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末样品中可能含有SiO2、Fe2O3、CaO、CuO、MgO、Na2O和炭粉等成分,为确认其中的组分,某同学设计并完成了如下实验:
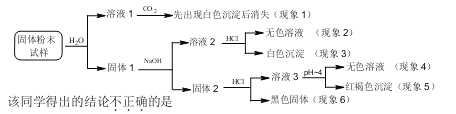
A.从现象1和3可推断样品中有CaO,没有Na2O
B.从现象3可推断样品中有SiO2
C.从现象4和5可推断样品中有Fe2O3和MgO
D.从现象4和6可推断样品中有炭粉,无CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液浓度偏高的是
A.溶解搅拌时有液体飞溅
B.用量筒量取浓盐酸时仰视读数
C.定容时仰视容量瓶瓶颈刻度线
D.定容摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6molA和3molB,发生反应如下:3A(g)+bB(g)![]() 3C(g)+2D(g)ΔH<0;4min时甲容器内的反应恰好达到平衡,
3C(g)+2D(g)ΔH<0;4min时甲容器内的反应恰好达到平衡,
A的浓度为2.4mol/L,B的浓度为1.8mol/L;tmin时乙容器内的反应达平衡,
B的浓度为0.8mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=______________。
(2)乙容器中反应达到平衡时所需时间t__________4 min(填“大于”、“小于”或“等于”)。
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是______________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器体积和温度都不变,向甲中加入一定量的A气体
D.保持容器体积和温度都不变,向甲中加入一定量的B气体
(4)该温度下,向体积为1L的密闭容器中通入A、B、C、D气体物质的量分别为3mol、1mol、3mol、2mol,此时反应________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”))
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH4+)∶c(NO3-)=1∶1,可以采取的下列措施是
A.加入适量的HNO3,抑制NH4+水解 B.加入适量的氨水,使溶液的pH等于7
C.加入适量的NH4NO3(s) D.加入适量的NaOH,使溶液的pH等于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
A.增大反应物的浓度,活化分子百分数增加,反应速率加快
B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
①2Cu(s)+![]() O2(g)===Cu2O(s) ΔH=-169 kJ·mol-1,
O2(g)===Cu2O(s) ΔH=-169 kJ·mol-1,
②C(s)+![]() O2===CO(g) ΔH=-110.5 kJ·mol-1,
O2===CO(g) ΔH=-110.5 kJ·mol-1,
③2Cu(s)+ O2(g)===2CuO(s) ΔH=-314 kJ·mol-1
(1)则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为______________________。
(2)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。

请回答下列问题:
①甲池为__________(填“原电池”“电解池”或 “电镀池”),A电极的电极反应式为______________
②丙池中电池总反应的离子方程式:_______________________
③当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为______mL(标准状况)。
④一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是________(填选项字母)。
A.CuO B. Cu C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com