
【题目】研究NO2、SO2 . CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
(2)已知:2SO2(g)+O2(g)![]()
![]() 2SO3(g)△H=﹣196.6kJmol﹣1
2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应SO2(g)+NO2(g)=SO3(g)+NO(g)的△H=kJmol﹣1
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H0(填“>”或“<”)实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 . 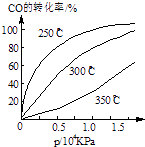
【答案】
(1)3NO2+H2O=2HNO3+NO;6.72
(2)﹣41.8;B;![]()
(3)<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失
【解析】解:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO,反应6NO2+8NH3![]() 7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,体积为6.72L,所以答案是:3NO2+H2O=2HNO3+NO,6.72;(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1②2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1 , 利用盖斯定律将①×
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,体积为6.72L,所以答案是:3NO2+H2O=2HNO3+NO,6.72;(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1②2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1 , 利用盖斯定律将①× ![]() ﹣②×
﹣②× ![]() 得NO2(g)+SO2(g)SO3(g)+NO(g)△H=
得NO2(g)+SO2(g)SO3(g)+NO(g)△H= ![]() ×(﹣196.6kJmol﹣1)﹣
×(﹣196.6kJmol﹣1)﹣ ![]() ×(﹣113.0kJmol﹣1)=﹣41.8kJmol﹣1 , A.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误; B.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故B正确; C.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故C错误;
×(﹣113.0kJmol﹣1)=﹣41.8kJmol﹣1 , A.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故A错误; B.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故B正确; C.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故C错误;
D.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2 , 不能判断是否达到平衡状态,故D错误.
NO2(g)+SO2(g)SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a﹣x 2a﹣x x x
平衡时NO2与SO2体积比为1:6,即(1a﹣x):(2a﹣x)=1:6,故x= ![]() a,故平衡常数K=
a,故平衡常数K= ![]() =
= ![]() =
= ![]() =
= ![]() ,所以答案是:﹣41.8;B;
,所以答案是:﹣41.8;B; ![]() ;(3)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强.所以答案是:<,在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失.
;(3)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强.所以答案是:<,在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】2020年的新型冠状病毒中,口罩和医用酒精在防疫工作中起到重要作用,医用口罩由三层无纺布制成,无纺布的主要原料是聚丙烯树脂。下列说法正确的是( )
A.84消毒液、二氧化氯泡腾片可作环境消毒剂
B.聚丙烯树脂属于合成无机高分子材料
C.医用酒精中乙醇的体积分数为 95%
D.抗病毒疫苗冷藏存放的目的是避免蛋白质盐析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.非极性分子只能是双原子单质分子
B.键能越大,表示该分子越容易受热分解
C.液态氟化氢中氟化氢分子之间存在氢键
D.分子中中心原子通过 sp3 杂化轨道成键时,该分子一定为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,能大量共存的一组离子是( )
A.pH=1的溶液中:NH4+、Fe2+、SO ![]() 、Cl﹣
、Cl﹣
B.通入过量SO2气体的溶液中:Fe3+、NO3﹣、Ba2+、H+
C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO ![]() 、SO
、SO ![]()
D.由水电离出的c(H+)=1×10﹣13 mol/L的溶液中:Na+、HCO ![]() 、Cl﹣、Br﹣
、Cl﹣、Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断错误的是 ( )
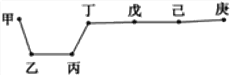
A. 甲可能是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 丙与戊的最高价氧化物的水化物可以相互反应
D. 庚的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学与技术]水处理技术在生产、生活中应用广泛.
(1)含有较多离子的水称为硬水.硬水加热后产生碳酸盐沉淀的离子方程式为(写出一个即可)
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应首先使硬水通过(填“RH”或“ROH”)型离子交换树脂,原因是 .
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 . 电渗析法净化水时,使离子通过半透膜的推动力是 .
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中,有A.B两种气体,反应按下式进行A(g)+B(g)═2C(g)反应经过2S后浓度不再发生变化时,测得容器中各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L.
(1)B物质的起始浓度为
(2)2S时A的转化率
(3)用物质A表示反应的平均速率 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
选项 | 含杂质的物质 | 试剂 | 除杂方法 |
A | C2H4(SO2) | NaOH溶液 | 洗气 |
B | C6H6(苯酚) | 浓Br2水 | 过滤 |
C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
D | C2H2(H2S) | CuSO4溶液 | 洗气 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com