
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016-2017学年江西省高一上月考二化学卷(解析版) 题型:填空题
(1)实验室用Na2CO3?10H2O晶体配制0.05mol/L的Na2CO3溶液970mL,应选用的容量瓶的规格 ,称取Na2CO3?10H2O的质量是 g。
(2)2molO3和3molO2的质量之比为 ,分子数之比为 ,同温同压下的密度之比为 ,含氧原子数之比为 。
(3)现有下列九种物质①AgCl ②铜 ③液态醋酸 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦酒精 ⑧稀硝酸 ⑨熔融FeCl3
①上述状态下可导电的是(填序号,下同) ,属于电解质的是 ,属于非电解质的是 。
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:填空题
氨气常用作致冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料。
(1)下图是当反应器中按按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.加催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(2)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶质为 。
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方程式是 。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:填空题
合成氨工业上常用下列方法制备H2 :
:
方法①:C(s)+2H2O(g) CO2(g)+2H2(g)
CO2(g)+2H2(g)
方法②:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO2(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为_________kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:
C(s)+2H2O(g) CO2(g)+2H2(g)其相关数据如下表所示:
CO2(g)+2H2(g)其相关数据如下表所示:

①T1_________T2(填“>”、“=”或“<”);
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是____________。
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
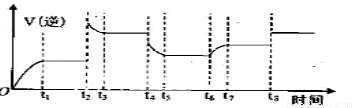
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是_____________,从t1到t8哪个时间段H2O(g)的平衡转化率最低____________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列事实可以证明亚硝酸是弱酸的是( )
① 0. 1 mol/L HNO2溶液的pH=2;
1 mol/L HNO2溶液的pH=2;
② HNO2溶液不与Na2SO4溶液反应;
③ HNO2溶液的导电性比盐酸弱;
④ 25℃时NaNO2溶液的pH大于7;
⑤ 将pH=2的HNO2溶液稀释至原体积的100倍,溶液的pH=3.7
A.①③④ B.①④⑤ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1 mol/L CH3COOH溶液 | pH = 3CH3COOH溶液 |
下列说法正确的是(  )
)
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH>5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.等体积等pH的④溶液和盐酸分别与足量的Zn反应,④溶液生成同条件下氢气体积多
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
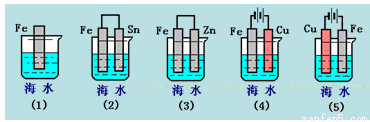
A.(5)(2)(1)(3)(4) B.(2)(5)(3)(4)(1)
C.(5)(3)(4)(1)(2) D.(1)(5)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
D.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江高级中学高三上期中化学卷(解析版) 题型:选择题
下列表述正确的是
A.0.1 mol/L的(NH4)2SO4溶液:c(SO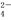 )>c(NH
)>c(NH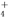 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.0.1 mol/L的NaHCO3溶液:c(Na+)=c(HCO )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO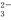 )
)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液:
2c(H+)+ c(CH3COOH) = c(CH3COO- ) +2c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com