
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 有三个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
回答下列问题:
(1)A元素在周期表中的位置_______________;
(2)B元素原子结构示意图_______________;
(3)A、B、D按原子半径从大到小排序依次为_______________(用元素符号表示);
(4)元素D与元素A相比,非金属性较强的是_______________(用元素符号表示),下列表述中不能证明这一事实的是_______________(填选项序号)。
a 一定条件下D和A的单质都能与钠反应
b D的氢化物比A的氢化物稳定
c D单质能与A的氢化物反应生成A单质
d A的最高价含氧酸酸性弱于D的最高价含氧酸
【答案】第三周期ⅥA族 ![]() Na>S>Cl Cl a
Na>S>Cl Cl a
【解析】
短周期元素中:A有三个电子层,K、M层电子数之和等于L层电子数,则核外各层电子数分别为2、8、6,应为S元素,B为短周期中金属性最强的元素,根据金属性的递变规律可知B为Na元素,C常温下单质为双原子气态分子,氢化物的水溶液呈碱性,则C为N元素,D元素最高正价是+7价,则应为第ⅦA族的Cl元素,据此答题。
由分析可知:A为S元素,B为Na元素,C为N元素,D为Cl元素。
(1)A为S元素,原子核外有3个电子层,最外层电子数为6,应位于周期表第第三周期ⅥA族,故答案为:第三周期ⅥA族。
(2)B元素为Na元素,原子核外有3个电子层,最外层电子数为1,则核外电子排布示意图为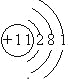 ,故答案为:
,故答案为: 。
。
(3)A为S元素,B为Na元素,D为Cl元素,同一周期元素的原子半径从左向右逐渐减小,所以原子半径从大到小排序依次为Na>S>Cl,故答案为:Na>S>Cl。
(4)A为S元素,D为Cl元素,同一周期,从左向右,元素的非金属性逐渐增强,所以非金属性较强的是Cl,
a.一定条件下D和A的单质都能与钠反应,说明都具有氧化性,但不能说明非金属性的强弱,故a错误;
b.D的氢化物比A的氢化物稳定,说明D的非金属性较强,故b正确;
c.D单质能与A的氢化物反应生成A单质,说明D的非金属性较强,故c正确;
d.A的最高价含氧酸酸性弱于D的最高价含氧酸,说明D的非金属性较强,故d正确。
故答案为:Cl,a。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道,“性最烈。能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指()
A. 氨水 B. 醋 C. 硝酸 D. 卤水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一枚洁净的铁钉浸入稀硫酸中,下列叙述正确的是( )
①铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量减轻 ④溶液的质量减轻
A.②③B.①②④C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用HCl和O2制备氯气并检验氯气性质的装置如图所示。下列说法正确的是

A. ①、②中盛放的试剂依次为浓盐酸、浓硫酸
B. 管式炉中发生反应时,氧化剂与还原剂的物质的量之比为1:2
C. 实验结東时先停止加热,关闭K,再从④中拿出导管
D. 装置Q(贮气瓶)可用于贮存NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以电解锰阳极泥废渣(主要成分为MnO2、Pb2+、Cu2+、Mg2+、K+及Cl—等)和木屑(主要成分为纤维素)为原料制取MnSO4的工艺流程如下:

(1)“反应1”的产物为C6H12O6,硫酸作______(填“氧化剂”“还原剂”或“催化剂”),
(2)为提高锰的浸取率,采取的措施合理的是_______(填标号)。
a.缩短浸取和搅拌的时间 b.适当升高浸取的温度 c.加人更多的阳极泥
(3)“操作1”的目的是_______,“操作3”的目的是___________。
(4)”滤液2”制取MnSO4晶体还需进行的操作有浓缩结晶、过滤、_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子因发生水解反应而不能大量共存的是
A. Ba2+、Cl-、Na+、SO42- B. Al3+、K+、HCO3-、Cl-
C. H+、Fe2+、NO3-、SO42- D. H+、Na+、Cl-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com