
分析 n(HCl)=0.8mol,结合反应可知n(MnO2)、n(Cl2),结合m=nM、V=nVm计算.
解答 解:n(HCl)=0.8mol,由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑可知,n(MnO2)=0.8mol×$\frac{1}{4}$=0.2mol,其质量为0.2mol×87g/mol=17.4g,
n(Cl2)=n(MnO2)=0.2mol,其标况下体积V=nVm=0.2mol×22.4L/mol=4.48L,
答:有17.4gMnO2参加反应,同时产生的Cl2在标准状况下的体积是4.48L.
点评 本题考查化学反应的计算,为高频考点,把握反应中物质的量关系及物质的量计算的相关公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
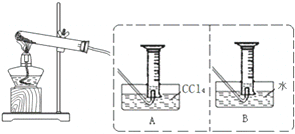 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:1 | C. | 1:1:2 | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取粗硅的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| B. | 硫酸型酸雨的形成会涉及反应2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| C. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2: 2ClO-+CO2+H2O=2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
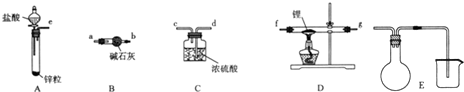
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中硝酸表现了氧化性和酸性 | |
| B. | 硝酸铵既是氧化产物又是还原产物 | |
| C. | 该反应中被氧化与被还原的物质的质量比为260:63 | |
| D. | 该反应中电子转移数目为8e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com