
【题目】如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是

A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
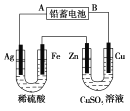
(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。
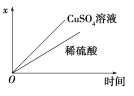
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学选修:化学与技术某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图:
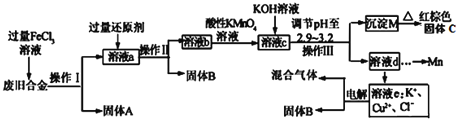
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是________;
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________;
(6)工业上由红棕色固体C制取相应单质常用的方法是________
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是( )
A. 实验室制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 在NaCl溶液中滴入AgNO3溶液:Ag++Cl-===AgCl↓
C. Cl2溶于水:Cl2+H2O===2H++Cl-+ClO-
D. 用NaOH溶液吸收Cl2:Cl2+2OH-===Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷结构为立方体,分子式为C8H8,其熔点比相同碳原子的辛烷高,立方烷的结构简式如图所示。下列有关立方烷的说法正确的是( )
A.其一氯代物只有1种,二氯代物有2种
B.常温常压下为气体
C.与乙苯(结构简式为![]() )是同分异构体
)是同分异构体
D.与苯的含碳质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
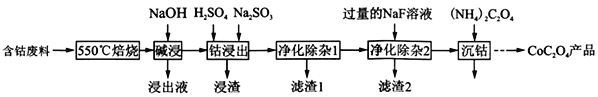
(1)“550℃焙烧”的目的是_____________________________。
(2)“浸出液”的主要成分是__________________。
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为_________________________。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是__________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中c(Mg2+)为__________________。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为___________。
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷同为VA族元素,它们的单质和化合物在生产、生活中有广泛应用。回答下列问题:
(1)下列有关氮原子电子排布图中,能量最低和最高的分别为____、___。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)![]() 是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与
是一种芳环硝化中间体,其中氮原子的杂化轨道类型为____,与![]() 互为等电子体的化合物分子是___(任写一种,填化学式)。
互为等电子体的化合物分子是___(任写一种,填化学式)。
(3)C、N、O是第二周期相邻的三种非金属元素,它们的第一电离能由大到小的顺序为____;NH3是一种极易溶于水的气体,其沸点比AsH3的沸点______(填“低”或“高”),其原因是______。
(4)砷是制造新型半导体的材料,同时砷的化合物又具有较强的毒性。
1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为___;AsCl3分子的空间构型为_____。
(5)2018年7月《Science》报道,BingLv等通过反应:4BI3+As4![]() 4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
4BAs+6I2合成了具有极高导热性的半导体新材料BAs。BAs晶胞结构如图所示:
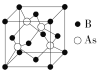
已知该晶胞参数为a pm,NA表示阿伏加德罗常数,则该晶胞的密度ρ=_____g·cm3(用代数式表示,可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号________________ ,该能层具有的原子轨道数为________________、电子数为________________。
(2)硅主要以硅酸盐、________________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________________相结合,其晶胞中共有8个原子,其中在面心位置贡献________________个原子。
(4)单质硅可通过甲硅烷(SiH4) 分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
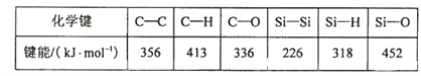
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________SiH4的稳定性小于CH4,更易生成氧化物,原因是 ________________。
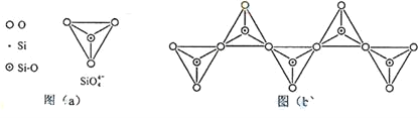
(6)在硅酸盐中,SiO44+四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为________________。Si与O的原子数之比为 ________________ 化学式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。
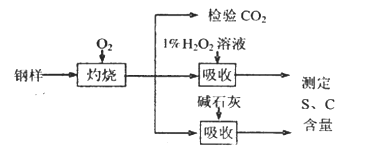
(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000 mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。
①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com