
| m |
| n |
| 500mL×1mol/L |
| 16mol/L |
| 0.2mol |
| 2 |
| 9.5g |
| 0.1mol |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:

| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaH2为离子化合物,在水中能以Ca2+和H-离子形式存在 |
| B、在原电池反应中,负极发生的是还原反应 |
| C、在肥皂水(高级脂肪酸的钠盐溶液)中,若干个阴离子的烃基相互聚集形成胶粒,其直径在1nm-100nm之间,所以肥皂水也能发生丁达尔现象 |
| D、pH=1的醋酸溶液与pH=13的NaOH溶液等体积混合后,所得溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.00mol |
| B、0.500mol |
| C、0.275mol |
| D、0.250mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、XY3 |
| B、XY |
| C、X3Y |
| D、X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,28 g N2所含的分子数多于NA |
| B、标况下,16 g O2所含原子数是NA |
| C、电子数是NA的NH3的物质的量是1 mol |
| D、17 g OH-中质子总数比电子总数多NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
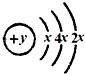 ;F的最外层电子数是电子层数的2倍.
;F的最外层电子数是电子层数的2倍.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com