
| A. | 给试管内液体加热时,液体体积不应超过试管容积的$\frac{1}{3}$ | |
| B. | 过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体 | |
| C. | 测定某溶液的pH将干燥试纸浸入到待测溶液,过一会儿取出,与标准比色卡比较 | |
| D. | 用容量瓶配置一定物质的量浓度溶液时,容量瓶必须干燥 |
分析 A.给试管中液态加热时,为了避免液态溅出,液体体积不应超过试管容积的$\frac{1}{3}$;
B.过滤时不能用玻璃杯搅拌,否则易损坏滤纸;
C.不能将试纸进入待测液中,否则待测液被污染;
D.配制溶液时,容量瓶不需要干燥.
解答 解:A.给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的$\frac{1}{3}$,以防止液体沸腾时喷出伤人,故A正确;
B.蒸发时为了受热均匀,需要使用玻璃棒搅拌,而过滤时不能使用玻璃棒搅拌,否则容易将滤纸捣破,影响过滤效果,故B错误;
C.pH试纸的使用方法:取一小块试纸在表面皿或玻璃片上,用沾有待测液的玻璃棒点试纸的中部,观察颜色的变化,然后与标准比色卡对照以测定该溶液的pH,故C错误;
D.容量瓶不需要干燥,定容前及定容时均需加蒸馏水,则容量瓶中原来有水对溶液配制无影响,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及化学实验基本操作方法、pH试纸的使用方法、溶液配制等知识,明确常见化学实验基本操作方法为解答关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是 SiO2 | |
| B. | 石英玻璃常用来制耐高温的化学仪器 | |
| C. | 硅酸盐工业使用的每一种原料中都含有硅 | |
| D. | 水泥和普通玻璃都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
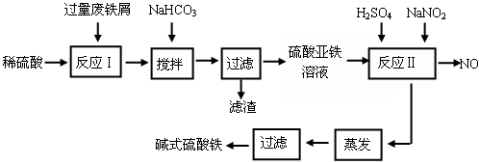
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸后者多 | D. | 后者放出CO2的量是前者的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯气和消石灰制漂白粉 | B. | 铝热法冶炼金属铁 | ||
| C. | 用油脂制肥皂 | D. | 电解水制H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常用明矾或硫酸铝做净水剂 | |
| B. | 实验室将氯化铁晶体溶于浓盐酸来配制饱和氯化铁溶液 | |
| C. | 用热的纯碱液清洗餐具表面的油污比用冷的溶液效果好 | |
| D. | 泡沫灭火器中用NaHCO3溶液和Al2(SO4)3溶液发生反应产生CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
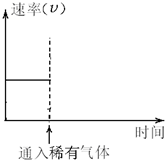 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
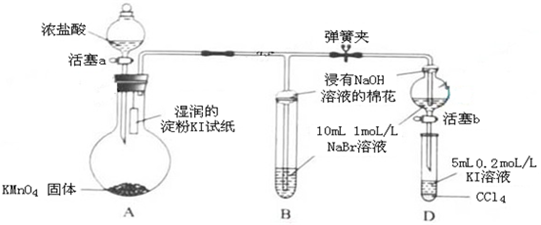
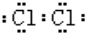 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.03 mol/(L•min) | B. | v(NH3)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com