
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
分析 X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,Z在短周期元素中金属性最强,则Z是Na元素;
X与W、Y与R分别同主族,W元素原子的次外层电子数为最外层电子数的2倍,W次外层是L层,则W是Si元素,X为C元素;
R的原子序数是Y的2倍,且二者位于同一主族,则Y是O元素、R是S元素;
A.W是Si元素、Y是O元素,原子电子层数越多其原子半径越大;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.Y是O元素、Z是Na元素,电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,Z在短周期元素中金属性最强,则Z是Na元素;
X与W、Y与R分别同主族,W元素原子的次外层电子数为最外层电子数的2倍,W次外层是L层,则W是Si元素,X为C元素;
R的原子序数是Y的2倍,且二者位于同一主族,则Y是O元素、R是S元素;
A.W是Si元素、Y是O元素,原子电子层数越多其原子半径越大,W原子电子层数大于Y,所以原子半径W>Y,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性R>W,所以最高价含氧酸酸性:W<R,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Y>R,则氢化物的稳定性Y>R,故C正确;
D.Y是O元素、Z是Na元素,电子层结构相同的离子,离子半径随着原子序数增大而减小,两种离子的电子层结构相同,所以离子半径Y>Z,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生对元素周期律的综合应用,明确原子结构、元素周期表结构及元素周期律内涵是解本题关键,熟练掌握元素周期律并灵活运用,题目难度不大.


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入 碳粉一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定NO3-浓度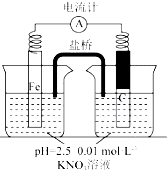 | Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
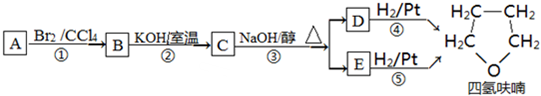
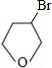 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$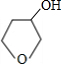 +NaBr.
+NaBr.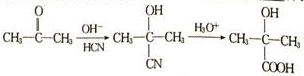 ,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成
,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成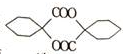 ,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)
,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)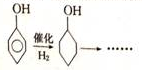
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、②、③、④均只有两种结构 | |
| B. | ①的同分异构体数目与④的相同 | |
| C. | ③一定是丙醛 | |
| D. | 若②与④能发生酯化反应,则生成的酯最多有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

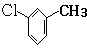 ,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.
,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.  ),下列有关G的叙述正确的是B.(填选项)
),下列有关G的叙述正确的是B.(填选项)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验时皮肤受碱腐蚀,先用大量水冲洗,再用2%醋酸溶液或硼酸溶液洗,最后用水冲洗 | |
| B. | 萃取操作时,要快速振摇分液漏斗,放气时支管口不能对着人,也不能对着火 | |
| C. | 淀粉溶液中加入稀硫酸,加热后再加入适量银氨溶液,水浴加热,可以判断淀粉是否水解 | |
| D. | 液态溴乙烷中加入NaOH溶液共热几分钟,然后滴加AgNO3溶液,可以检验溴乙烷中含溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+CO3-+2H2O | |
| C. | 0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com