
【题目】I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)写出碳酸的第一步电离方程式__________________________________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN![]() ),下列关系正确的是_______。
),下列关系正确的是_______。
a.c(H+)>c(OH![]() ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH![]() ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN![]() )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10![]() mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10![]() mol/L,则此溶液中由水电离产生的c(H+)=_________。
mol/L,则此溶液中由水电离产生的c(H+)=_________。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10![]() 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L![]() ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________。(Ksp(FeS)=6.3×10![]() ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10![]() )
)
【答案】H2CO3![]() H++HCO3- ②>①>③ CN
H++HCO3- ②>①>③ CN![]() + CO2 + H2O = HCO3-+ HCN C 8.0×10-10mol/L 5 HgS Hg2+(aq)+Fe(S)
+ CO2 + H2O = HCO3-+ HCN C 8.0×10-10mol/L 5 HgS Hg2+(aq)+Fe(S)![]() Hg +Fe2+(aq)
Hg +Fe2+(aq)
【解析】
I.(1)多元弱酸应分步电离;
(2)利用盐类水解中“越弱与水解”进行分析;
(3)根据电离常数判断;
(4)通过c(Na+)>c(CN-),判断出以电离还是水解为主;
II.(1)根据水的离子积,计算pH;
(2)利用溶度积进行计算;
(3)利用溶度积的原则进行分析;
I.(1)碳酸是二元弱酸,在溶液中分步电离,电离方程式为:H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-,
H++CO32-,
故答案为H2CO3![]() H++HCO3-;
H++HCO3-;
(2)三种盐都是强碱弱酸盐,水溶液显碱性,根据表中数据,电离H+能力:CH3COOH>H2CO3>HCN>HCO3-,利用盐类水解中“越弱越水解”,得出水解能力大小顺序是CO32->CN->CH3COO-,即pH由大到小的顺序是②>①>③。
故答案为②>①>③;
(3)电离出H+能力:H2CO3>HCN>HCO3-,因此NaCN中通入少量的CO2,其离子方程式为CN-+H2O+CO2=HCN+HCO3-,
故答案为:CN-+H2O+CO2=HCN+HCO3-;
(4)HCN和NaOH等体积混合,反应后溶液中的溶质为NaCN和HCN,且两者物质的量相等,因为c(Na+)>c(CN-),说明CN-的水解能力大于HCN的电离能力,溶液显碱性,a、根据上述分析,溶液显碱性,即c(OH-)>c(H+),故a错误;
b、电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-),物料守恒:c(CN-)+c(HCN)=2c(Na+),两式联立得到2c(H+)+c(HCN)=2c(OH-)+c(CN-),故b错误;
c、根据物料守恒,c(CN-)+c(HCN)=0.01mol·L-1,故c正确;
c正确,故答案为c;
II.(1)纯水中水电离c(H+)等于水电离出的c(OH-),即该温度下,水的离子积Kw=4×10-7×4×10-7=1.6×10-13,该温度下,滴入盐酸,根据水的离子积c(OH-)=![]() =8×10-10mol·L-1,即水电离出的c(H+)= 8×10-10mol·L-1,
=8×10-10mol·L-1,即水电离出的c(H+)= 8×10-10mol·L-1,
故答案为8×10-10mol·L-1;
(2)根据浓度商与Ksp之间的关系,当Qc=Ksp时,此时溶液为饱和溶液,即要使Cu(OH)2开始出现沉淀,c(OH-)>![]() =1×10-9mol·L-1,则pH应大于5,
=1×10-9mol·L-1,则pH应大于5,
故答案为5;
(3)Ksp(FeS)>Ksp(HgS),说明HgS比FeS更难溶,即先有HgS沉淀产生;反应向更难溶的方向进行,即发生的离子方程式为Hg2+(aq)+FeS=Hg+Fe2+(aq),
故答案为HgS;Hg2+(aq)+FeS=Hg+Fe2+(aq)。


科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
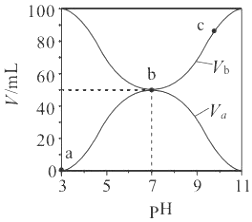
A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列热化学方程式:
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式______________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
t/K | 298 | 398 | 498 |
K/(mol/L)-2 | 4.1×106 | K1 | K2 |
①比较K1、K2的大小,K1__________K2(填写“>”“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是_________(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度______(填“增大”或“减小”或“不变”,下同),NH3的体积分数__________。
(3)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
①其平衡常数可表示为_____________。
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为_________(用百分数表示),该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是υ正____υ逆(选填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④B.密度②>③>④>①
C.质量②>③>①>④D.氢原子数①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g)达到平衡.下列说法正确的是
CaO(s)+CO2(g)达到平衡.下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2(g), △H<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下进行化学反应![]() ,B、D起始浓度均为0,反应物A的浓度
,B、D起始浓度均为0,反应物A的浓度![]() 随反应时间的变化情况如下表:下列说法不正确的是( )
随反应时间的变化情况如下表:下列说法不正确的是( )
序号 | 时间 温度 | 0 | 20 | 40 | 50 |
① | 800 |
|
|
|
|
② | 800 | x |
|
|
|
③ | 800 | y |
|
|
|
④ | 820 |
|
|
|
|
A.①中B在![]() min平均反应速率为
min平均反应速率为![]()
![]()
B.②中![]() ,可能使用了催化剂
,可能使用了催化剂
C.③中![]()
![]()
D.比较①④可知,该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求用合适的化学用语填空
(1)基态P原子的电子排布式:______________
(2)Fe3+ 外围电子排布图:_______________
(3)用电子式表示MgCl2的形成过程:_______
(4)用水解方程式表示明矾能净水的原因:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是

A. 石油与煤是可再生能源
B. CO2是煤、石油形成淀粉、纤维素等的催化剂
C. 光合作用将太阳能转化为化学能
D. 图中所出现的物质中淀粉与纤维素为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com