
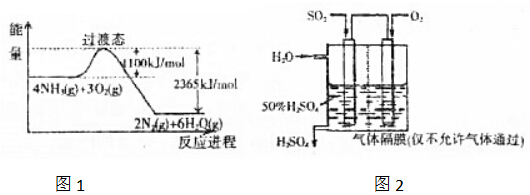
���� I����1����ͼ�ɵã�4NH3��g��+3O2��g��=2N2��g��+6H2O��g����H=-��2365-1100��kJ•mol-1=-1265kJ•mol-1������Ӧ��=��Ӧ����ܼ���-��������ܼ��ܣ�
��2����ͼ�ɵã�4NH3��g��+3O2��g��=2N2��g��+6H2O��g����H=-1265kJ•mol-1 ��
��֪N2��g��+O2��g��?2NO��g����H=+180kJ/mol ��
���ݸ�˹���ɣ���+�ڡ�2�ɵã�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����
��1����ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ����ƽ��ʱ���������Ũ��ϵ������֮���뷴Ӧ���Ũ��ϵ������֮���ıȣ����塢��Һ�岻��Ҫ�ڻ�ѧƽ�ⳣ����д����
�����ʱŨ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У������ж�v��������v���棩��Դ�С��
��2�����º�ѹ�£��������֮�ȵ������ʵ���֮�ȣ��ɵ�ƽ��������������ʵ��������ò���������μӷ�Ӧ������������ʵ���������������������ת���ʣ�
��3����Ӧ��2SO2��g��+O2��g��?2SO3��g����H��0
A�������¶Ȳ��������������䣬����1.0molO2��ƽ�������ƶ���
B�������¶Ⱥ�������ѹǿ���䣬����1.0molSO3��ת��������ʽ��ߣ�����SO2��2�����ʵ���֮��Ϊ2��1����ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱͬ����ֵ�Ũ����ԭƽ����ȣ�
C�������¶ȣ�ƽ�������ƶ���
D���ƶ�����ѹ�����壬�����С�������Ũ������
��4����ͼ��֪���������������������ᣬͨSO2�ĵ缫Ϊ������
��� �⣺I����1����ͼ�ɵã�4NH3��g��+3O2��g��=2N2��g��+6H2O��g����H=-��2365-1100��kJ•mol-1=-1265kJ•mol-1��
��N-H����Ϊamol/L��O-H����Ϊbmol/L����Ӧ��=��Ӧ����ܼ���-��������ܼ��ܣ���12��a mol/L+3��497kJ/mol-2��946kJ/mol-12��b mol/L=-1265kJ/mol�������ɵã�a-b=-72��
�ʴ�Ϊ��72��
��2����ͼ�ɵã�4NH3��g��+3O2��g��=2N2��g��+6H2O��g����H=-1265kJ•mol-1 ��
��֪N2��g��+O2��g��?2NO��g����H=+180kJ/mol ��
���ݸ�˹���ɣ���+�ڡ�2�ɵã�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-1265kJ•mol-1 +2��180kJ/mol=-905 kJ/mol��
�ʴ�Ϊ��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-905 kJ/mol��
��1��2SO2��g��+O2��g��?2SO3��g����ƽ�ⳣ������ʽK=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}����c��{O}_{2}��}$����ʱŨ����Qc=$\frac{��\frac{3}{100}��^{2}}{��\frac{3}{100}��^{2}��\frac{16}{100}}$=$\frac{100}{16}$��K=$\frac{100}{3}$����Ӧ������Ӧ���У���v��������v���棩��
�ʴ�Ϊ��$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}����c��{O}_{2}��}$������
��2�����º�ѹ�£��������֮�ȵ������ʵ���֮�ȣ���ƽ��������������ʵ���Ϊ��2+1��mol��$\frac{1.6L}{2L}$=2.4mol��
2SO2��g��+O2��g��?2SO3��g�����ʵ�����С��n
2mol 1mol
1.2mol 3mol-2.4mol=0.6mol
����������ת����Ϊ$\frac{1.2mol}{2mol}$��100%=60%��
�ʴ�Ϊ��60%��
��3����Ӧ��2SO2��g��+O2��g��?2SO3��g����H��0
A�������¶Ȳ��������������䣬����1.0molO2��ƽ�������ƶ���SO2��g��ƽ��Ũ�ȼ�С����A��ȷ��
B�������¶Ⱥ�������ѹǿ���䣬����1.0molSO3��ת��������ʽ��ߣ�����SO2��2�����ʵ���֮��Ϊ2��1����ԭƽ��Ϊ��Чƽ�⣬ƽ��ʱͬ����ֵ�Ũ����ԭƽ����ȣ���B����
C�������¶ȣ�ƽ�������ƶ���SO2��g��ƽ��Ũ�ȼ�С����C��ȷ��
D���ƶ�����ѹ�����壬�����С�������Ũ��������SO2��g��ƽ��Ũ������D����
��ѡ��AC��
��4����ͼ��֪���������������������ᣬͨSO2�ĵ缫Ϊ�������缫��ӦʽΪ��SO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ������SO2+2H2O-2e-=SO42-+4H+��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧƽ�ⳣ������Ӧ�á���Ӧ�ȼ��㡢�Ȼ�ѧ����ʽ��д��ԭ���ԭ���ȣ�����ƴ������Ŀ����Ҫѧ���߱���ʵ�Ļ������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
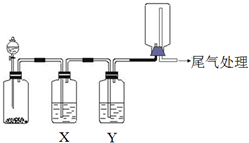 ������ͼװ�ÿ��Խ���ʵ�鲢�ܴﵽʵ��Ŀ���ǣ�������
������ͼװ�ÿ��Խ���ʵ�鲢�ܴﵽʵ��Ŀ���ǣ�������| ѡ�� | ʵ��Ŀ�� | X���Լ� | Y���Լ� |
| A | ��MnO2��Ũ������ȡ���ռ����������Cl2 | ����ʳ��ˮ | Ũ���� |
| B | ��Cu��ϡ������ȡ���ռ����������NO | ˮ | Ũ���� |
| C | ��֤��ʯ�뱥��ʳ��ˮ��Ӧ���ɵ���������ʲ��ռ� | CuSO4��Һ | KMnO4 ��Һ |
| D | CaCO3��ϡ������ȡ���ռ����������CO2 | ����NaHCO3��Һ | Ũ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ���±���
T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ���±���| Ԫ�� | �����Ϣ |
| T | TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��� |
| W | W��Tͬ���ڣ�������һ��δ�ɶԵ��� |
| X | Xԭ�ӵĵ�һ�����������ĵ����ֱܷ��ǣ�I1=578kJ•mol��I2=1817kJ•mol-1��I3=2745kJ•mol-1��I4=11575kJ•mol-1 |
| Y | ���³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���� |
| Z | Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaClO ��Һ��ͨ�����SO2��ClO -+SO2+H2O�THClO+HSO3- | |
| B�� | �״�������������������Һ��ɵ�ȼ�ϵ�صĸ�����ӦCH3OH+H2O-6e-�TCO2��+6H+ | |
| C�� | AlCl3 ��Һ��Ͷ�����Na��Al3++4Na+2H2O�TAlO2 -+4Na++2H2�� | |
| D�� | ��������Һ�еμ�Ba��OH��2��ǡ��ʹSO42- ������ȫ��2Al3++3SO4 2-+3Ba2++6OH -�T2Al��OH��3��+3BaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
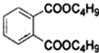 +2NaOH$\stackrel{��}{��}$
+2NaOH$\stackrel{��}{��}$ +2CH3CH2CH2CH2OH��
+2CH3CH2CH2CH2OH���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ƿ�����̼ԭ�Ӹ������������ǵ����� | |
| B�� | ���Ƕ��������ֵ�����ɵĻ���� | |
| C�� | ����ˮ����Եõ����ֵ��� | |
| D�� | ÿ���Ӷ���ˮ��������������ӵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
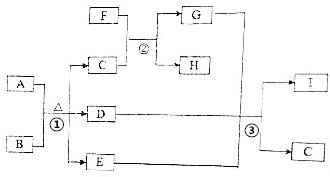 �й����ʵ�ת����ϵ��ͼ��ʾ�������������뷴Ӧ��������ȥ����A�dz����ķǽ������嵥�ʣ�F���Ϻ�ɫ�Ľ������ʣ�B��C�dz�����ǿ�ᣬD��G��I�dz��������壬D��I�����Ԫ����ͬ����D����Է���������I�Ĵ�16��E���������ɫҺ�壮��ش��������⣺
�й����ʵ�ת����ϵ��ͼ��ʾ�������������뷴Ӧ��������ȥ����A�dz����ķǽ������嵥�ʣ�F���Ϻ�ɫ�Ľ������ʣ�B��C�dz�����ǿ�ᣬD��G��I�dz��������壬D��I�����Ԫ����ͬ����D����Է���������I�Ĵ�16��E���������ɫҺ�壮��ش��������⣺ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
1.2mol Cl2��Ԫ��A������ȫ��Ӧ����0.80mol AClx����xֵΪ
A��1 B��2 C��3 D��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������и�һ��9�µ��л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�жԴ������м�⣬������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȡ���PM2.5����������ˮ�����Ƴ���Һ������Һ������ˮ���������ӵ�Ũ�����±���
���� | K+ | Na+ | NH4+ | H + | SO42�� | NO3�� | Cl�� |
Ũ��/mol��L��1 | 4��10��6 | 6��10��6[ | 2��10��5 | x | 4��10��5 | 3��10��5 | 2��10��5 |
���ݱ��������ж�H+ ��Ũ��Ϊ mol��L��1
A��1��10��5 mol��L��1 B��3��10��5 mol��L��1
C��6��10��5 mol��L��1 D��1��10��4mol��L��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com