
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
分析 反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol,
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
以此解答该题.
解答 解:反应2s后测得C的浓度为0.6mol/L,物质的量=0.6mol/L×2L=1.2mol,
2A(g)+B(g)?2C(g)
起始量(mol) 4 2 0
变化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
A.用物质A表示2 s内的平均反应速率为$\frac{\frac{1.2mol}{2L}}{2s}$=0.3 mol/(L•s),故A正确;
B.用物质B表示2s内的平均反应速率为$\frac{\frac{0.6mol}{2L}}{2s}$=0.15 mol/(L•s),故B错误;
C.2 s后物质B的浓度为$\frac{1.4mol}{2L}$=0.7 mol/L,故C错误;
D.2 s后物质A的转化率为$\frac{1.2}{4}×100%$=30%,故D正确.
故选AD.
点评 本题考查化学平衡计算,为高频考点,题目难度中等,涉及反应速率、平衡浓度、转化率的计算,明确反应速率与计量数的关系是解本题关键,会根据公式进行推导,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
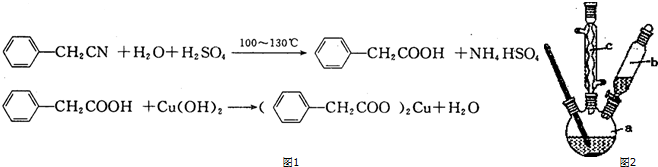
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
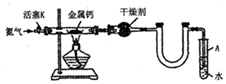
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 操作 | 现象 |
 | 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
| A. | 烧杯A中发生反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | |
| B. | 红棕色气体消失只与NO2和烧杯C中的KI发生反应有关 | |
| C. | 烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关 | |
| D. | 若将铜片换成铁片,则C中的液体也可能变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com