
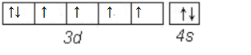
 ,故答案为:
,故答案为: ;
; ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:4、
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个 π键,故答案为:4、 ;
;| 4r | ||
|
4
| ||
| 3 |
| 1 |
| 8 |
4
| ||
| 3 |
| NA |
| 2 |
| M |
| Vm |
| 55.9 | ||||||
(
|
2×55.9×3
| ||
| NA×64r3 |
2×55.9×3
| ||
| NA×64r3 |


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
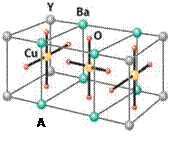
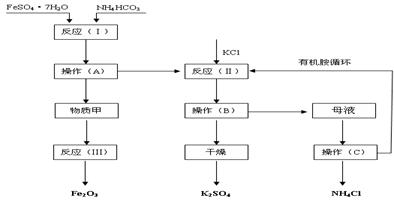
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.32 | B.65 | C.120 | D.150 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
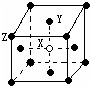
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由分子间作用力结合而成,熔点很低 |
| B.固体不导电,但溶于水或熔融后能导电 |
| C.由共价键结合成网状晶体,熔点很高 |
| D.固体或熔融后易导电,熔点在1000℃左右 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 叙述I | 叙述II |
| A | MgO和Al2O3的熔点都很高 | Mg(OH)2和Al(OH)3可以作阻燃剂 |
| B | SO2具有漂白性 | SO2能使高锰酸钾酸性溶液褪色 |
| C | AlCl3的熔融态不导电 | AlCl3是弱电解质 |
| D | Fe3+具有氧化性 | Fe3+与KSCN溶液显血红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
| B.硅在电子工业中是最重要的半导体材料,广泛用于制作光导纤维 |
| C.二氧化硫是一种有毒气体,所以不能用于杀菌消毒 |
| D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com