
| 3 |
| 2 |
| N |
| NA |
| 3 |
| 2 |
| 0.3mol×3 |
| 2 |
| cb |
| a |
| ||
| NAmol-1 |
| bc |
| aNA |
| bc |
| aNA |
| 22.4bc |
| aNA |
| 22.4bc |
| aNA |
| ||
| ||


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
 短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.Y是地壳中含量最多的元素.下列说法正确的是( )
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.Y是地壳中含量最多的元素.下列说法正确的是( )| A、1mol Q单质与氢氧化钠溶液反应转移的电子数目为2NA |
| B、X的气态氢化物能使湿润的蓝色石蕊试纸变红 |
| C、氢化物的沸点:H2Y>HQ |
| D、最髙价氧化物的水化物的酸性:W>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| CH3OH |
| Ⅰ |
| (1)O2 |
| (2)Zn,H2O |
| 新制Cu(OH)2 |
| H+ |
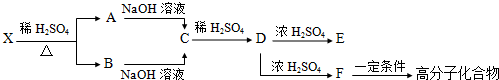
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学-选修5:有机化学基础】
【化学-选修5:有机化学基础】查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com