
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
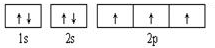 ;Fe为d区;
;Fe为d区; ;d;N>O>C;
;d;N>O>C;| 6-2×2 |
| 2 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
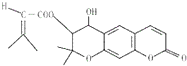 紫花前胡丙素具有祛谈解痉,抗血小板聚集、抑制癌细胞的生长等作用,它的结构简式如图,有关紫花前胡丙素的说法正确的是( )
紫花前胡丙素具有祛谈解痉,抗血小板聚集、抑制癌细胞的生长等作用,它的结构简式如图,有关紫花前胡丙素的说法正确的是( )| A、能使溴的四氯化碳溶液褪色 |
| B、1mol紫花前胡丙素最多可与含3molNaOH的溶液完全作用 |
| C、分子中能有原子可以处于同一平面 |
| D、能与氯化铁溶液作用显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | ||
B、
| ||
| C、由水电离产生c (H+)=10-10mol/L的溶液:NH4+、AlO2-、Ca2+、S2- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:K+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下反应C(s)+CO2(g)=2CO(g)不能自发进行,说明其△H<0 |
| B、25℃时PH=5的盐酸和PH=9的氨水,两溶液中水的电离程度不同 |
| C、25℃时Ksp(A)>Ksp(B),说明化合物A的溶解度比化合物B的大 |
| D、在NH4Cl溶液中加入适量的硫酸,可使c(NH4+):c(Cl-)接近1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
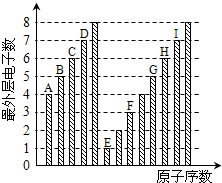
| A、原子半径:A<B<C<D |
| B、E和C元素形成的化合物中只可能存在离子键 |
| C、气态氢化物稳定性:I>D>H>G |
| D、E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量数均为14的碳原子和氮原子表示为:614C 714N |
B、甲烷的球棍模型: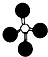 |
C、甲基的结构式: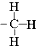 |
D、甲基负离子的电子式: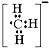 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L稀盐酸中,Cl-数为0.1NA |
| B、2.24 L NH3中含N-H键数目为0.3NA |
| C、2.8g N2和2.8g CO所含分子数均为0.1NA |
| D、0.lmol H2O2完全分解转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应是氧化还原反应 |
| B、MnO2是氧化剂 |
| C、HCl是还原剂 |
| D、HCl被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
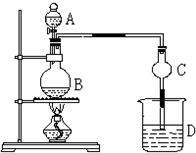 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com