
| A. | AlCl3 | B. | HCl | C. | NaCl | D. | HAc |
分析 离子化合物在熔融状态时,能够电离出自由移动的离子,能够导电,据此分析.
解答 解:A.AlCl3是共价化合物,熔融状态不电离,没有自由移动的离子不导电,故A错误;
B.HCl是共价化合物,熔融状态不电离,没有自由移动的离子不导电,故B错误;
C.NaCl是离子化合物,熔融的NaCl是化合物,能电离出自由移动离子,能导电,故C正确;
D.液态HAc只存在分子,无自由移动的离子不导电,故D错误;
故选C.
点评 本题考查电解质概念的辨析以及物质能导电条件,注意:电解质必须是化合物,必须有自由移动的离子,且离子是其本身电离的.电解质的强弱与电离程度有关,与溶液的导电能力无关,题目难度不大


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
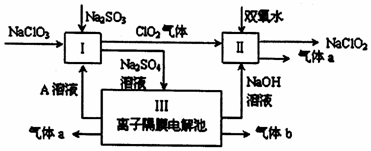
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:
我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
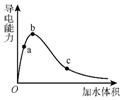 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
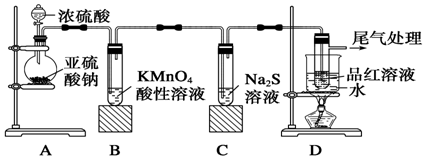
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com