
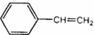
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | 既能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| B. | 易溶于水和有机溶剂 | |
| C. | 能与H2在一定条件下发生反应 | |
| D. | 能发生加聚反应,生成物可用 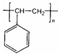 表示 表示 |
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有⑤⑦ | C. | 只有①③⑦ | D. | 只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
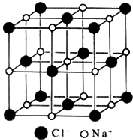
| A. | 在NaCl晶体中,每个Na+周围与其距离最近的Na+有6个 | |
| B. | 氯离子采取A2密堆积,钠离子填入八面体空隙中 | |
| C. | 每个晶胞含2个Na+和2个Cl- | |
| D. | 氯化钠的化学式为NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、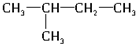 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: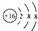 | |
| B. | HCl的电子式: | |
| C. | 乙酸的结构式:C2H4O2 | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
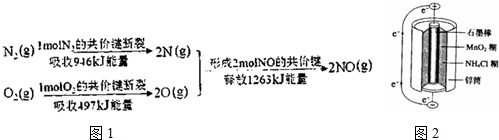
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
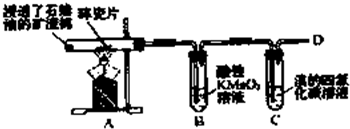 乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.
乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com