
【题目】(1)某元素原子的价电子构型为4s24p1,该元素的符号为________。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________,B的元素名称为________。
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
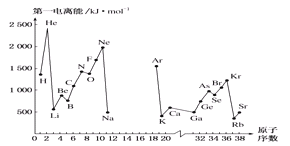
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________<Al<________;(填元素符号)。
②图中第一电离能最小的元素在周期表中的位置是第________周期________族。
【答案】Ga Fe ![]() 钙 Na Mg 五 IA
钙 Na Mg 五 IA
【解析】
(1)元素元素价电子构型为4s24p1,处于P区,为主族元素,为第四周期第ⅢA族元素Ga;
(2)元素+3价离子的3d轨道半充满,该离子的电子排布式为1s22s22p63s23p63d5,故原子的核电荷数为23+3=26,为Fe元素;
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,核外电子数为18,A原子质子数为16,B原子质子数为20,故A为S元素,B为Ca元素,S2-离子的结构示意图为:![]() ;
;
(4)①由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg;
②金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期IA族。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
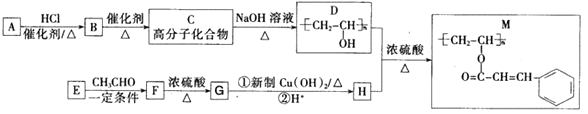
已知:

请回答:
(1)B的化学名称为_______________;M中含氧官能团的名称为_______________;F→G的反应类型为____________________。
(2)C→D的化学反应方程式为_________________________________________。
(3)E的结构简式为_______________;H的顺式结构简式为___________________。
(4)同时满足下列条件的F的同分异构体有_________种(不考虑立体异构):①属于芳香族化合物;②能发生水解反应和银镜反应。写出其中一种核磁共振氢谱有4种吸收峰,其峰面积之比为6:2:1:1的物质的结构简式_________。
(5)参照上述合成路线和相关信息,以乙烯和乙醛为原料(无机试剂任选)合成有机物![]() , 设计合成路线_____________。
, 设计合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
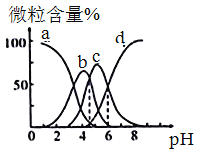
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. Na2HR溶液中HR2-的水解程度大于电离程度
C. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是_____________。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B_____________;沉淀D_______________;溶液E_______________。
(3)写出①、④两个反应的化学方程式
①___________________________;④______________________________。
(4)写出②、③两个反应的离子方程式
②__________________________;③______________________________。
(5)设计实验检验溶液F中所含溶质:_________________________________________________。
(6)分别写出固体B和沉淀D在工业上的一种主要用途:
固体B:______________________;沉淀D:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E、F均为短周期元素(原子序数B<A<F<E<D)。25℃时,其最高价氧化物的水化物(设浓度均为0.001mol/L)溶液的pH和原子半径的关系如图所示。下列说法中正确的是
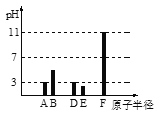
A. A和F的简单离子半径大小顺序:A < F
B. 上述五种元素中有两种元素是金属元素
C. D的最高价氧化物水化物的化学式为HDO3
D. D、E的气态氢化物的稳定性:D > E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com