
某一反应物的浓度为3mol/L,经5秒钟后,浓度变为2mol/L,则这5秒里该反应物的平均反应速率是 ( )
A.0.2 mol/s B.0.2 mol·L/s C.0.2 mol/(L·s) D.12 mol/(L·min)
科目:高中化学 来源: 题型:阅读理解
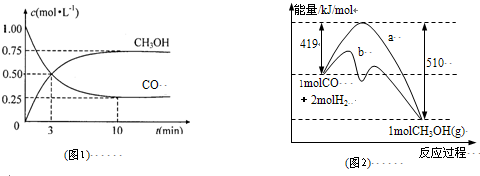
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |
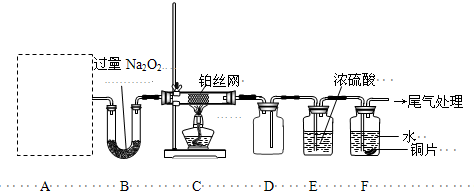
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 |
反应温度 (℃) |
参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
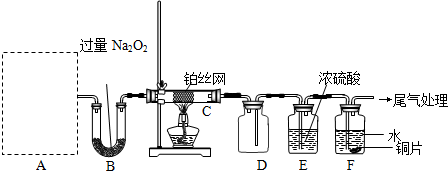


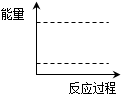
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol?L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
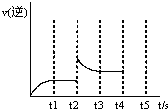
查看答案和解析>>
科目:高中化学 来源:新疆哈巴河县高级中学2010-2011学年高二上学期第一次月考化学试题 题型:021
|
某一反应物的浓度为3 mol/L,经5秒钟后,浓度变为2 mol/L,则这5秒里该反应物的平均反应速率是 | |
A. |
0.2 mol/s |
B. |
0.2 mol·L/s |
C. |
0.2 mol/(L·s) |
D. |
12 mol/(L·min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com