
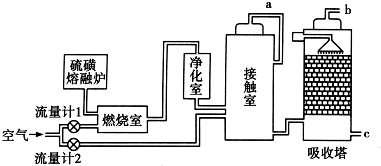
分析 (1)①SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
②燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,则流量计2中通入氧气的体积为1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-x=5.775x,剩余SO2为0.05x,故b管尾气中SO2的体积分数为0.41%;SO2为酸性氧化物,可以用碱性物质吸收;
③硫铁矿为原料燃烧消耗的大量的氧气,产生的废渣较多,产生废气量相同,原料选择与SO2的转化率无关,据此分析解答;
(2)硫酸可以与苯发生磺化反应,制备“烷基苯磺酸钠”;可以用来制备铅蓄电池;可以与磷矿石反应制备过磷酸钙,据此分析解答;
(3)碳酸钙分解生成氧化钙、氧化钙与二氧化硫反应生成亚硫酸钙,亚硫酸钙不稳定,被氧气氧化生成硫酸钙,所以在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放.
解答 解:(1)①SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
故答案为:热交换器;增加三氧化硫与浓硫酸的接触面积,有利于三氧化硫的吸收;
②燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,则流量计2中通入氧气的体积为1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-x=5.775x,剩余SO2为0.05x,故b管尾气中SO2的体积分数为0.41%;SO2为酸性氧化物,可以用碱性物质吸收,所有可以用氨水吸收二氧化硫;
故答案为:6:5;0.0041;用氨水吸收;
③A.硫铁矿中铁的氧化需要消耗O2,故A正确;
B.原料选择与SO2的转化率无关,故B错误;
C.用硫铁矿为原料产生的废渣较多,但废气量相同,故C错误;
用SO2制取SO3的过程中都需要使用催化剂,故D错误;
故选:A;
(2)A.橡胶硫化所用到的为单质硫,故A错误;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,故B正确;
C.铅蓄电池中需要用到硫酸和硫酸铅,故C正确;
D.过磷酸钙的制取过程中需要浓硫酸和磷矿石,故D正确;
故选:BCD;
(3)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,所以发生反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ SO2+CaO$\frac{\underline{\;\;△\;\;}}{\;}$CaSO3 2CaSO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4;
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ SO2+CaO$\frac{\underline{\;\;△\;\;}}{\;}$CaSO3 2CaSO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4.
点评 本题为工艺流程题,考查了硫酸的制备工艺及硫酸性质、用途,明确接触法制备硫酸原理及硫酸的性质和用途是解题关键,注意钙基固硫的方法,题目难度中等.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:实验题
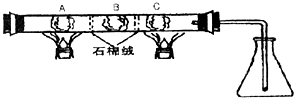 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
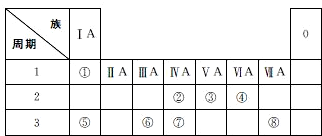
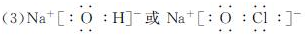 .
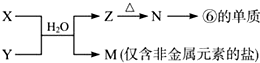
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
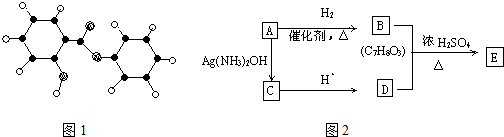

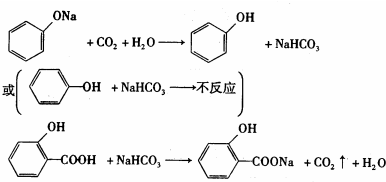 .
.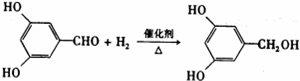 ;反应类型:加成反应.
;反应类型:加成反应.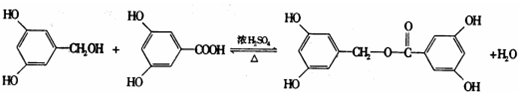 ;反应类型:酯化反应
;反应类型:酯化反应查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
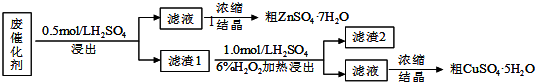
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com