
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.分析 (1)高温条件下,SiHCl3与氢气反应生成Si与HCl;
(2)根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
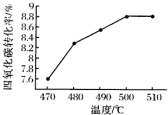
(3)由图可知,四氯化碳的转化率在500℃达最高;开始反应未到达平衡,温度升高反应速率加快,转化率增大;
(4)①根据v=$\frac{△c}{△t}$计算v(SiHCl3),再利用速率之比等于其化学计量数之比计算v(SiCl4);
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不需要写出;
升高温度,平衡向吸热反应方向移动,据此判断平衡常数变化;
③利用浓度变化量之比等于其化学计算之比计算H2的浓度变化量,进而计算氢气的起始浓度,再根据n=cV计算氢气的物质的量,根据V=nVm计算标况下氢气的体积;
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),等效为压强增大一倍,平衡向正反应方向移动;
⑤平衡后,将容器的体积压缩为1L,压强增大,平衡向正反应方向移动,若平衡不移动,此时氢气浓度为极大值,平衡移动不能消除氢气浓度增大,到达新平衡时的浓度仍大于原平衡时的浓度.
解答 解:(1)高温条件下,SiHCl3与氢气反应生成Si与HCl,反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
(2)已知:(i)Si(s)+4HCl(g)=SiCl4(g)+2H2(g)△H=-241kJ.mol-1
(ii)Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ.mol-1
则SiCl4转化为SiCl3的反应(iii):
(ii)×4-(i)×3可得:3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g),故△H=4×(-210kJ.mol-1
)-3×(-241kJ.mol-1)=-117kJ.mol-1,
故答案为:-117kJ.mol-1;
(3)由图可知,四氯化碳的转化率在500℃达最高,故最适宜的温度为500℃;开始反应未到达平衡,温度升高反应速率加快,四氯化碳的转化率增大,
故答案为:500℃;开始反应未到达平衡,温度升高反应速率加快,四氯化碳的转化率增大;
(4)①6h后达到平衡,SiHCl3的物质量浓度为0.2mol.L-1,则v(SiHCl3)=$\frac{0.2mol/L}{6h}$=$\frac{1}{30}$mol/(L.h),速率之比等于其化学计量数之比,则v(SiCl4)=$\frac{3}{4}$v(SiHCl3)=$\frac{3}{4}$×$\frac{1}{30}$mol/(L.h)=0.025mol/(L.h),
故答案为:0.025mol/(L.h);
②3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)的平衡常数表达式K=$\frac{{c}^{4}(SiHC{l}_{3})}{{c}^{3}(SiC{l}_{4})×{c}^{2}({H}_{2})}$,该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,
故答案为:$\frac{{c}^{4}(SiHC{l}_{3})}{{c}^{3}(SiC{l}_{4})×{c}^{2}({H}_{2})}$;减小;
③浓度变化量之比等于其化学计算之比,则H2的浓度变化量为0.2mol.L-1×$\frac{1}{2}$=0.1mol.L-1,故氢气的起始浓度为1mol.L-1+0.1mol.L-1=1.1mol.L-1,则通入氢气的物质的量为2L×1.1mol.L-1=2.2mol,标况下氢气的体积为2.2mol×22.4L/mol=49.28L,
故答案为:49.28L;
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),等效为压强增大一倍,平衡向正反应方向移动,有方程式可知1mol氢气反应时,混合气体总物质的量减小1mol,故到达新平衡时氢气的体积分数减小,
故答案为:减小;
⑤平衡后,将容器的体积压缩为1L,压强增大,平衡向正反应方向移动,若平衡不移动,此时氢气浓度为极大值为2×1mol.L-1=2mol.L-1,平衡移动不能消除氢气浓度增大,到达新平衡时的浓度仍大于原平衡时的浓度1mol.L-1,故再次达到平衡时,H2的物质的量浓度范围为:1mol.L-1<c(H2)<2mol.L-1,
故答案为:1mol.L-1<c(H2)<2mol.L-1.
点评 本题考查方程式书写、反应热计算、化学反应速率计算、平衡常数及影响因素、化学平衡计算及移动等,(4)中⑤注意利用极限法与平衡移动原理方向解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(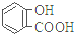 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于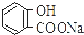 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 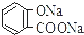 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 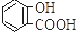 +2NaHCO3→ +2NaHCO3→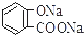 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| B. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| C. | 乙醇能使酸性高锰酸钾溶液褪色,发生的是氧化反应 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 糖类、油脂和蛋白质是基本营养物质,它们都是天然高分子化合物 | |
| C. | 可以用溴水鉴别苯、CCl4和无水乙醇 | |
| D. | 苯可以发生取代反应和加成反应,但是无法发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
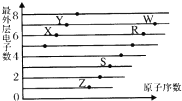 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | 该图体现出原子核外电子层呈现周期性变化 | |
| B. | 简单离子半径:W->R2->Z+>S3+ | |
| C. | R、Z形成的化合物中可能含有共价键 | |
| D. | 由酸性:HWO4>H2RO3可证明非金属性:W>R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L Na2CO3溶液中,阴离子总数大于0.1 NA | |
| B. | 常温常压下,1 mol甘氨酸中含C-H键数目为3 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA | |
| D. | 50℃时,10 L pH=13的NaOH溶液中含有的OH-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ”,当
”,当查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为H-F的键能大于H-CI,所以HF的沸点高于HCI | |
| B. | 因为HCIO4比HCIO中的氯元素的化合价高,所以HCIO4的氧化性强于HCIO | |
| C. | 因为N元素的非金属性比P元素强,所以NH3的稳定性强于PH3 | |
| D. | 因为Fe的还原性强于Cu,所以Cu2+的氧化性强于Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com