
如图表示1g O2与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能
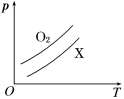
A.C2H4 B.CH4 C.CO2 D.NO
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:选择题
已知戊烷有3种同分异构体,戊基有8种同分异构体,则戊醇的同分异构体(属醇类)的数目有 ( )
A.5 种 B.6 种 C.7 种 D.8 种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
下列化学反应的离子方程式正确的是
A.用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O
B.往碳酸钙中滴加稀盐酸:CO32-+2H+═CO2↑+H2O
C.二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害.其在酸性条件下会产生NO和NO2.下列有关说法错误的是( )
A.NaNO2既具有氧化性又具有还原性
B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C.NaNO2和胃酸作用的离子方程式为:2NO2﹣+2H+═NO↑+NO2↑+H2O
D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合,在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9g 2CaSO4·H2O含有的结晶水分子数为0.02 NA (2CaSO4·H2O相对分子质量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.①②③④⑤⑦ B.②③⑤⑥ C.①③④⑤⑥ D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:简答题
氮及其化合物在工业生产和国防建设中有广泛应用。回答下列 问题:
问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程: 。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g)△H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将Ag I溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10-16,K稳Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
I溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10-16,K稳Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2 N2O4其相关图像如下。
N2O4其相关图像如下。
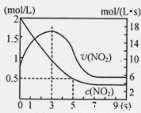
①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中等五校高二6月联考化学卷(解析版) 题型:选择题
现有6.4g铜与过量硝酸(8mol/L,50mL)充分反应,硝酸的还原产物为NO和NO2,反应后溶液中含有H+ 0.05mol。( 假定反应前后溶液体积不变),下列说法不正确的是
假定反应前后溶液体积不变),下列说法不正确的是
A.NO与NO2的物质的量之比为1:5
B.反应后溶液中所含NO3﹣的物质的量浓度为0.5 mol/L
C.被还原的硝酸的物质的量为0.15 mol
D.上述过程转移电子总的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高一下第六次半月考化学卷(解析版) 题型:推断题
以下物质A、B、C、X均属于中学常见的物质,已知它们之间有如下转化关系(其中副产物已被略去,例如H2O等)。

请根据上述转化关系回答下列问题:
(1)若X是具有强氧化性的气体单质,且B的分子式是CH2O,则X的化学式是________。
(2)若X是非氧化性强酸,且C是一种酸性氧化物,则C的化学式是_______(只要求写一例)。
(3)若X是金属单质,请写出反应②的离子方程式_________________________________。
(4)若X是强碱,且A、B、C都含有同一种金属元素,请写出反应②的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:实验题
(NH4)2Fe(SO4)2 6H2O(M=392g
6H2O(M=392g mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
Ⅰ.莫尔盐的制取
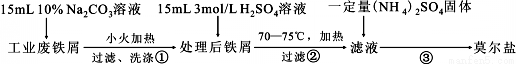
回答下列问题:
(1)步骤②必须在剩余少量铁屑时进行过滤,其原因是 。(用离子方程式表示)
(2)制取的莫尔盐最后要用 洗涤(填字母编号),其目的是: 。
a.蒸馏水 b.乙醇 c.滤液
(3)从下图中选取必须用的仪器连接成实验室制取(NH4)2SO4溶液的装置,连接的顺序(用接口字母表示)是_____________。
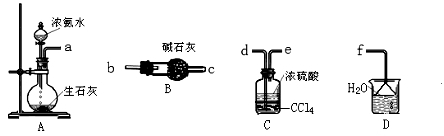
Ⅱ.FAS纯度测定
为测定FAS纯度,取m g样品配制成500 mL溶液,根据物质组成,甲、乙两位同学设计了如下两个实验方案。
(1)甲方案:取20.00 mLFAS溶液,用0.1000 mol·L-1 的酸性K2Cr2O7 溶液进行滴定。
i)写出此反应的离子方程式: 。
ii) 滴定时必须选用的仪器是 。
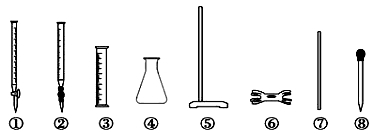
(2)乙方案:取20.00 mLFAS溶 液进行如下实验。
液进行如下实验。
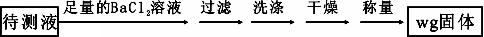
列出计算FAS晶体纯度的代数式 (不用计算出结果)。
(3)已知实验操作都正确,却发现甲方案的测定结果总是小于乙方案,其可能的原因是 ,设计简单的化学实验验证上述推测 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com