
分析 根据分子中的官能团分析,含有-OH的为醇类物质,若-OH直接和苯环相连则为酚类物质;含有羧基的属于羧酸;含有-COO-的为酯类物质.据此分析.
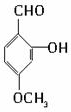
解答 解:有机物A的结构简式为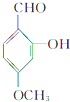 ,其分子中的官能团有醛基(-CHO),酚羟基,醚基(-O-);
,其分子中的官能团有醛基(-CHO),酚羟基,醚基(-O-);
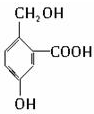
有机物B的结构简式为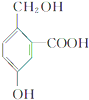 ,其分子中的官能团有羧基(-COOH),酚羟基,醇羟基;
,其分子中的官能团有羧基(-COOH),酚羟基,醇羟基;
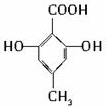
有机物C的结构简式为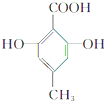 ,其分子中的官能团有羧基(-COOH),酚羟基;
,其分子中的官能团有羧基(-COOH),酚羟基;
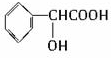
有机物D的结构简式为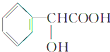 ,其分子中的官能团有羧基(-COOH),醇羟基;
,其分子中的官能团有羧基(-COOH),醇羟基;
有机物E的结构简式为 ,其分子中的官能团有酯基(-COO-);
,其分子中的官能团有酯基(-COO-);
(1)可以看作醇类的是BD;故答案为:BD;
(2)可以看作酚类的是ABC;故答案为:ABC;
(3)可以看作羧酸类的是BCD;故答案为:BCD;
(4)可以看作酯类的是E;故答案为:E.
点评 本题考查有机物的结构与有机物的分类,注意-OH与苯环直接相连的有机物属于酚,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
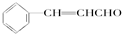 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: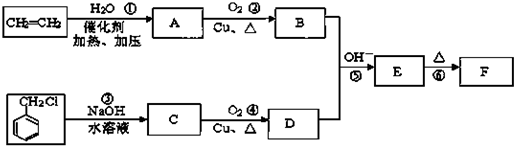
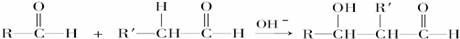
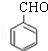 ;
;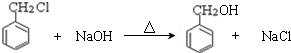 ,判断有关反应的类型:⑥消去反应;
,判断有关反应的类型:⑥消去反应;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 甲基的电子式: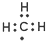 | D. | 硬脂酸的化学式:C17H33COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
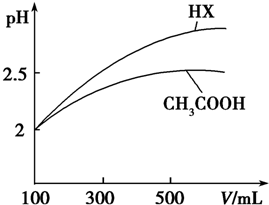
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com