
| A. | Na3N与水的反应是氧化还原反应 | |
| B. | Na3N 是共价化合物 | |
| C. | Na3N中4个离子均满足最外层8电子稳定结构 | |
| D. | Na3N中钠离子半径大于氮离子半径 |
分析 Na3N是离子化合物,由Na+和N3-构成,根据离子的结构可知,电子层数相同,所以半径大小取决于核电荷数,核电荷数越大,离子半径越小;离子化合物中不存在共价键;该化合物与水反应生成NaOH和NH3可知是氮化纳发生的剧烈的水解反应,反应前后元素化合价没有变化,所以不是氧化还原反应.
解答 解:A、Na3N与水的反应为,Na3N+H2O=NaOH+NH3↑,反应前后各元素化合价没变化,不是氧化还原反应,故A错误;
B、Na3N是有三个钠离子和一个氮离子构成,存在离子键,不存在共价键,是离子化合物,故B错误;
C、Na3N中钠离子和氮离子的电子层数相同,均含有10个电子,则4个离子均满足最外层8电子稳定结构,故C正确;
D、Na3N中钠离子和氮离子的电子层数相同,电子层数相同离子半径由核电荷数决定,核电荷数越大,离子半径越小,所以钠离子半径小于氮离子半径,故D错误;
故选C.
点评 本题考查了离子半径的大小比较,离子化合物的构成特征,水解的反应过程,主要考查了信息应用的能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;由A→B的反应类型是:还原反应.
;由A→B的反应类型是:还原反应. .
. 为原料制备化合物X(
为原料制备化合物X( )(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.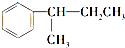 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com