
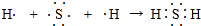 .
.分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;A与C可形成两种液态化合物,其分子中电子总数分别为10和18,则形成的化合物为H2O和H2O2,则C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,则D为Al元素;由原子序数可知E处于第三周期,E元素原子的最外层电子数是其电子层数的2倍,则E为S元素.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;A与C可形成两种液态化合物,其分子中电子总数分别为10和18,则形成的化合物为H2O和H2O2,则C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,则D为Al元素;由原子序数可知E处于第三周期,E元素原子的最外层电子数是其电子层数的2倍,则E为S元素.
(1)E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,位于周期表第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)所有元素中H原子半径最小,同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:Al>S>N>O>H,
故答案为:Al>S>N>O>H;
(3)A与C形成的18电子物质为H2O2,含H-O极性共价键、O-O非极性共价键,
故选:BC;
(4)A和E形成的化合物为H2S,用电子式表示其形成过程为: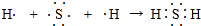 ,
,
故答案为: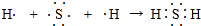 ;
;
(5)C、E的氢化物分别为H2O、H2S,水分子之间形成氢键,而硫化氢分子之间不能,故水的沸点高于硫化氢的,
故答案为:H2O;
(6)氮元素的最高价氧化物的水化物与其氢化物相互反应的化学方程式:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3.
点评 本题考查位置、结构、性质的关系及应用,推断元素为解答的关键,注意氢键对物质性质的影响,掌握用电子式表示物质或化学键的形成.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁溶液鉴别苯酚溶液、辛烯、溴苯和乙醇四种有机物 | |
| B. | 用溴水鉴别苯、辛烯、甲苯和乙醇四种有机物 | |
| C. | 用酸性高锰酸钾溶液鉴别苯、甲苯、硝基苯四种液态有机物 | |
| D. | 用硫酸铜溶液除去乙炔中的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量苯,振荡、静置后 现象:CCl4层呈橙红色. | 假设1正确 |
| ②向溶液中加入KSCN溶液溶液 现象:溶液变为红色. | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl的最高氧化物对应的水化物酸性最强 | |
| B. | S元素的族序数等于周期数3倍 | |
| C. | C元素的最高正价与最低负价代数和为零 | |
| D. | N元素的气态氢化物和它的最高价氧化物对应水化物能起化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或反应 | 原理解释 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com