
| A�� | ��Ϸ�ĩ�����ʵ���֮��һ�����㣺n��Cu��+n��Fe��=n��Fe2O3�� | |
| B�� | ��Ϸ�ĩ�����ʵ���֮��һ�����㣺n��Fe����n��Cu����n��Fe2O3�� | |
| C�� | ��Ϸ�ĩ�����ʵ���֮��һ�����㣺n��Cu��+n��Fe���Tn��Fe2O3��+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D�� | ��a=72.50��b=1.12����20.40g��Ϸ�ĩ�У�n��Fe��=n��Cu��=0.05mol��n��Fe2O3��=0.09mol |
���� ��Ӧ�����Һ�е���KSCN��Һ����Һ���Ժ�ɫ��˵����Һ��û��Fe3+���ҽ���amL������Ϸ�ĩ��ȫ�ܽ⣬ͬʱ������bL����״����H2�������ķ�Ӧ�У�
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O��
Cu+Fe2O3+3H2SO4=2FeSO4+CuSO4+3H2O��
Fe+H2SO4=FeSO4+H2���ۣ�
���ݷ���ʽ�٢ڢ۵�n��Fe��+n��Cu��=n��Cu��+n��Fe���Tn��Fe2O3��+$\frac{bL}{22.4L•mo{l}^{-1}}$��
���a=72.50��b=1.12��
�����е�H+��ȫ��Ӧ������H2��H2O������Hԭ���غ��n��H2SO4��=n��H2��+n��H2O������n��H2O��=4.00mol/L��0.0725L-$\frac{1.12L}{22.4L/mol}$=0.29mol-0.05mol=0.24mol��
����Oԭ���غ����n��Fe2O3����
����ת�Ƶ����غ㼰Cu��Fe����������n��Fe����n��Cu����
��� �⣺��Ӧ�����Һ�е���KSCN��Һ����Һ���Ժ�ɫ��˵����Һ��û��Fe3+���ҽ���amL������Ϸ�ĩ��ȫ�ܽ⣬ͬʱ������bL����״����H2�������ķ�Ӧ�У�
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O��
Cu+Fe2O3+3H2SO4=2FeSO4+CuSO4+3H2O��
Fe+H2SO4=FeSO4+H2���ۣ�
���ݷ���ʽ�٢ڢ۵�n��Fe��+n��Cu��=n��Cu��+n��Fe���Tn��Fe2O3��+$\frac{bL}{22.4L•mo{l}^{-1}}$��
���a=72.50��b=1.12��
�����е�H+��ȫ��Ӧ������H2��H2O������Hԭ���غ��n��H2SO4��=n��H2��+n��H2O������n��H2O��=4.00mol/L��0.0725L-$\frac{1.12L}{22.4L/mol}$=0.29mol-0.05mol=0.24mol��
����Oԭ���غ��n��Fe2O3��=$\frac{1}{3}$n��H2O��=$\frac{1}{3}$��0.24mol=0.08mol��
��m��Fe��+m��Cu��=20.40g-160g��0.08=7.6g��
��n��Fe��=xmol��n��Cu��=ymol�����ת�Ƶ����غ��
$\left\{\begin{array}{l}{56x+64y=7.6}\\{2x+2y=0.08��2��1+0.05��2}\end{array}\right.$
���$\left\{\begin{array}{l}{x=0.09}\\{y=0.04}\end{array}\right.$��
��n��Fe��=0.09mol��n��Cu��=0.04mol��n��Fe2O3��=0.08mol��
ͨ�����Ϸ���֪��ֻ��C��ȷ��
��ѡC��
���� ���⿼��������йؼ��㣬���ؿ���ѧ���������㼰֪ʶ�ۺ�������������ȷ��Һ�����ʳɷּ�����֮�䷢���ķ�Ӧ�ǽⱾ��ؼ���ע�ⷴӦ������ԭ���غ㼰ת�Ƶ����غ��������ã���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʼ����NaOH��Һʱ����������ɫ���� | |
| B�� | ԭ����������þ��������1.2g | |
| C�� | V=100mL | |
| D�� | ����5.1g�úϽ���������������������Һ���ڳ��³�ѹ�·ų�3.36L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4g D2������O2��Ӧ������D2O 2NA�� | |
| B�� | 98g H3PO4��H2SO4�Ļ�����к���ԭ��2.5NA�� | |
| C�� | 6.02��1023�������Ƿ���Լ���ǻ�6NA�� | |
| D�� | 1molNa��ȫȼ�տ�ת�Ƶ���NA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.6g��0.1mol | B�� | 4.6g��0.2mol | C�� | 0.3g��0.2mol | D�� | 5.0g��0.4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
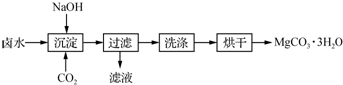
�鿴�𰸺ͽ���>>
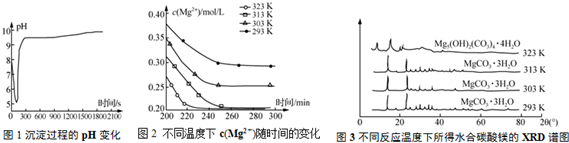
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
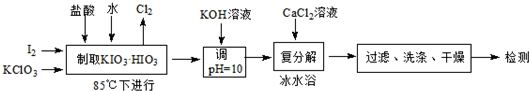
| �¶�/�� | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca��IO3��2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| ����ƴ�����̬ | ��ˮ�� | һˮ���� | ��ˮ���� |
| �ȶ�ʱ���¶����� | ��57.5�� | 32-57.5�� | ��32�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu | B�� | Si | C�� | SiO2 | D�� | Al2O3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com