
(15分)氢化钙固体是登山运动员野外常用的能源提供剂。某化学兴趣小组拟选用如下装置制备氢化钙。已知:氢化钙在一定条件下与氧气反应生成的产物不只一种。
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为______________(填仪器接口的字母编号)。
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗
活塞;______________(请按正确的顺序填入下列步骤的标号)。
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
(1)i→e,f→d,c→j(或k),k(或j)→a(2分) (2)BADC(2分)
(3)①CaH2 + 2H2O=Ca(OH)2+2H2↑ (3分)
②不准确 金属钙与水反应也有类似现象(2分)
(4)取适量氢化钙,在加热条件下与干燥的氧气反应,将反应的气体产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变蓝色 (4分)
(5)氢化钙是固体,携带方便 (2分)
解析试题分析:(1)钙属于极活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氢气中会混有水蒸气和氯化氢,所以在与钙化合之前需要除杂和干燥,分别选用试剂是氢氧化钠和浓硫酸;同时为防止空气中水蒸气进入,最后还需要连接干燥管,所以正确的顺序为:i→e,f→d,c→j(或k),k(或j)→a;
(2)由于多余的氢气需要燃烧反应掉,所以应该先收集一部分气体并检验其纯度,反应结束后还需要使氢化钙在氢气的氛围中冷却,所以应该最后关闭分液漏斗活塞,因此正确的顺序为BADC;
(3)①CaH2与水反应能产生Ca(OH)2和H2,反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
②CaH2和Ca与水反应都能产生Ca(OH)2和H2,反应方程式分别为:CaH2+2H2O=Ca(OH)2+2H2↑和Ca+2H2O=Ca(OH)2+H2↑,因此不能根据反应后溶液呈碱性判断是否含有CaH2;
(4)CaH2可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色,即操作为:取适量氢化钙,在加热条件下与干燥的氧气反应,将反应的气体产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变蓝色;
(5)作为能源,氢化钙明显比氢气更易携带,使用也较方便。
考点:考查考查元素化合物知识,涉及到物质的性质和制备实验


科目:高中化学 来源: 题型:填空题
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)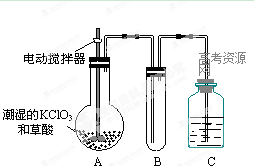
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如上图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A中反应还原剂与氧化剂的物质的量之比为1:2,该反应的化学方程式为 。
A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置: ;
②该装置按①补充完整后,装置A、B、C中还有一处设计明显不合理的是 _
(填“A、B或C”),理由是
③C中的试剂为NaOH溶液,反应时生成氯酸钠和亚氯酸钠(NaClO2),发该反应的离子方程式为 。若实验时需要450mL 4mol/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、胶头滴管、玻璃棒外,还必须有 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制备溴苯可用如图所示的装置,填写下列空白: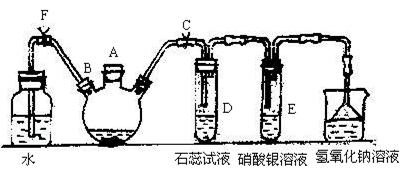
(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,反应一段时间制的溴苯。溴苯是一种密度比水 (填”小”或”大”)的无色液体,在实验中因为 而显褐色。则三口烧瓶中发生反应的化学方程式为___ __和__ _。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是__________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)硫酸锌被广泛应用于工农业生产和医药领域。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
⑶步骤Ⅲ所得滤渣C的主要成分是 。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②680 ℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(本题共10分)
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯)。亚硝酰氯的熔点为-64.5 ℃,沸点为-5.5 ℃,并且遇水蒸气分解为氮的氧化物和氯化氢。
某校化学兴趣小组按如下流程制备亚硝酰氯,实验时,先通入Cl2,待E中U形管内充满黄绿色气体时,再缓缓通入NO。“→”表示气流方向。
34.实验室用氯酸钾和浓盐酸制备Cl2的化学方程式是______________________________。
35.装置F的作用是___________________________________。
36.亚硝酰氯与水反应的化学方程式是________________________________。
37.实验中“先通入Cl2,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验: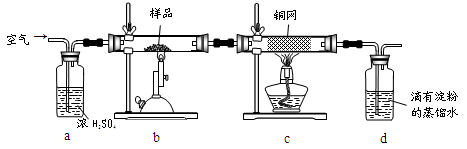
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的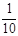 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
A除去SO2气体 B除去空气中的水蒸气 C有利于气体混合
D有利于观察空气流速 E除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。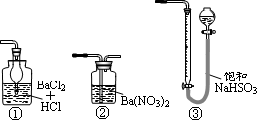
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下: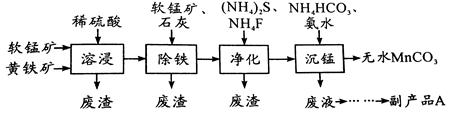
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)="0.01" mol?L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol?L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。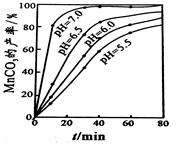
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是 。
副产品A的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
S2Cl2是工业上常用的硫化剂,实验室制备的方法有2种: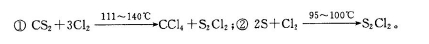 已知在S2Cl2中硫元素显+1价,电子式:
已知在S2Cl2中硫元素显+1价,电子式: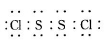 ,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生歧化反应 (一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下: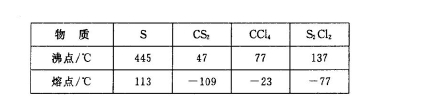
实验室利用下列装置制备 (部分夹持仪器已略去):
回答下列问题:
(1)写出A装置中发生反应的离子方程式
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是
(3)D中冷凝管起到导气和冷凝回流双重作用。这种冷却装置可应用于下列高中化学中 实验。
| A.石油分馏 | B.制备乙烯 | C.制取乙酸乙酯 | D.制取溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
无水氯化铝是一种重要的有机合成催化剂,还可用于金属冶炼、润滑油合成;食品级无水氯化铝也可用作膨松剂、絮凝剂等。
某研究性学习小组查阅资料后利用下图所示装置制备无水氯化铝。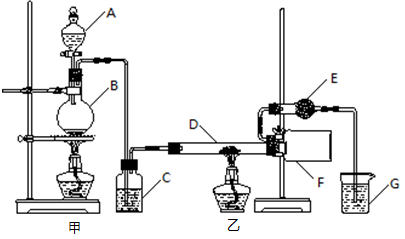
资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃升华,其蒸气是缔合分子(Al2Cl6),在空气中能吸收水分,发生水解。
(1)填写下列仪器的名称:A ,B 。
(2)装置C中盛装的试剂是 ;装置G中盛装的试剂是 。
(3)相同条件下,氯化铝蒸气对氢气的相对密度是 。
(4)装置F中的现象是 。
(5)装置E的作用是 。
(6)实验结束后应先撤去 (填“甲”或“乙”)处的酒精灯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com