
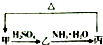
 甲、乙、丙三种物质之间有如下转化关系(如图):
甲、乙、丙三种物质之间有如下转化关系(如图):分析 (1)若丙是不溶于水的白色胶状沉淀,能溶于盐酸和氢氧化钠溶液,则丙为氢氧化铝,丙分解生成甲;
(2)若丙是不溶于水的红褐色沉淀,则丙为氢氧化铁,分解生成甲为氧化铁,以此来解答.
解答 解:(1)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是Al2O3,乙是Al2(SO4)3,丙是Al(OH)3,甲→乙的反应方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O,乙→丙的反应方程式为Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4,
故答案为:Al2O3;Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4;
(2)若丙是不溶于水的红褐色沉淀,则丙为氢氧化铁,分解生成甲,则甲是 Fe2O3,乙是Fe2(SO4)3,丙是Fe(OH)3.甲→乙的离子方程式为:Fe2O3+6H+=Fe3++3H2O,乙→丙的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,“丙$\stackrel{△}{→}$甲”转化的化学方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,乙溶液中大量存在的阳离子是Fe3+,检验方法为取乙溶液少许于试管中,滴几滴KSCN溶液,若变红,则存在,
故答案为:Fe3+;取乙溶液少许于试管中,滴几滴KSCN溶液,若变红,则存在;2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;Fe2O3+6H+=Fe3++3H2O.
点评 本题考查无机物的推断,为高频考点,把握Al、Fe及其化合物性质和相互转化为解答的关键,注意氢氧化铝的性质、红褐色沉淀为氢氧化铁为推断的突破口,侧重分析与推断能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 足量的铜与含2molH2SO4的浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA | |
| D. | 3mol铁与足量的水蒸气充分反应,转移电子8NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视刻度线 | |
| B. | 移液前容量瓶不干燥 | |
| C. | 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水 | |
| D. | 溶解所称NaCl并移液后,用蒸馏水洗涤烧杯2~3次,洗涤液转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使湿润的蓝色石蕊试纸变红的气体是氨气 | |
| B. | 瓷坩埚可用作Na2CO3与石英制Na2SiO3的反应容器 | |
| C. | 热Na2CO3溶液更利于清洗餐具上的油污 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的沉淀,该溶液一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com