
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | Si3N4 | Al(OH)3 | Si | Fe2O3 |
| 用途 | 制造汽车发动机 | 抗酸药 | 光导纤维 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Si3N4形成晶体为原子晶体,其硬度大,熔点高,可用于制造汽车发动机;
B.氢氧化铝为难溶物,能够中和酸;
C.晶体硅常用作半导体材料,光导纤维的主要成分为二氧化硅;
D.氧化铁为红棕色固体,可用作涂料.
解答 解:A.氮化硅是一种高温结构陶瓷材料,它的硬度大,熔点高,可用于制造汽车发动机,故A正确;
B.Al(OH)3与盐酸反应,且难溶于水,可用于治疗胃酸,故B正确;
C.光导纤维的主要成分为SiO2,晶体Si为良好的半导体材料,故C错误;
D.Fe2O3为红棕色粉末,俗称铁红,常用作涂料,故D正确;
故选C.
点评 本题考查了常见物质的组成、结构和性质的关系,题目难度不大,明确常见物质组成、性质及用途为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ⑥③⑤① | B. | ①②③⑤ | C. | ④⑥③① | D. | ④③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与CH3COOH溶液反应:Zn+2H+═Zn2++H2↑ | |
| B. | 氢氧化铝与稀硝酸反应:H++OH-═H2O | |
| C. | CuCl2溶液与铁粉反应:3Cu2++2Fe═3Cu+2Fe3+ | |
| D. | MgCl2溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C能促进人体对铁的吸收,利用了维生素C的氧化性 | |
| B. | 食品中大量添加苯甲酸钠灯防腐剂,可有效延长其保质期 | |
| C. | 《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,这是运用了焰色反应 | |
| D. | “从沙滩到用户”,计算机芯片的材料是指单质铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
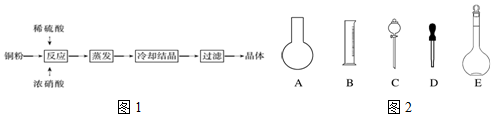
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
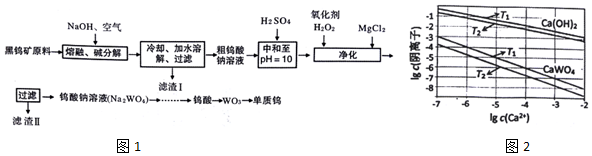
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| B. | 把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳 | |
| C. | 取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子 | |
| D. | 不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com