
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
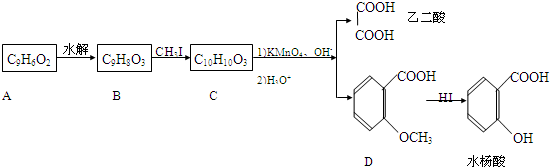
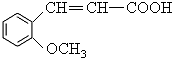
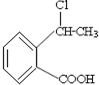 合成
合成 的反应流程图,请在方框内写出A与
的反应流程图,请在方框内写出A与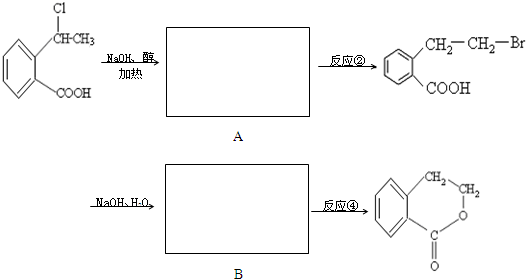
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
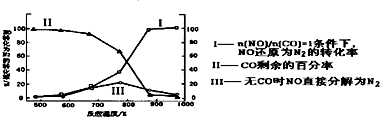
 有机物A的分子式为C2H4,可能发生以下系列转化:
有机物A的分子式为C2H4,可能发生以下系列转化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年3月5日,李克强总理在政府工作报告中说:“生态环保贵在行动、成在坚持,要求全年能耗强度下降3.1%以上”,从源头上消除污染,这符合“绿色化学”的理念 | |
| B. | 农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等均蕴藏着丰富的生物质能 | |
| C. | 硅藻泥材料具有很好的吸音降噪、净化空气、防霉防潮等性能,已成为当下时兴的环保装修材料,硅藻泥主要原材料为硅藻上,成分是SiO2,拥有多空的结构,具有强吸附性 | |
| D. | 把粉末状的氢化钛泡沫剂添加到熔融的金属铝中,冷却后可得到某种金属泡沫,利用该金属泡沫具有强度低、质量轻等特性可用于建造海上漂浮城市. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
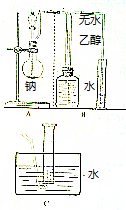 乙醇的分子式为C2H6O,有人设计了如图所示的实验来确定乙醇分子的结构.
乙醇的分子式为C2H6O,有人设计了如图所示的实验来确定乙醇分子的结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

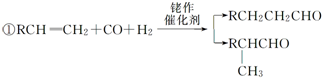
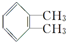 ,名称为邻二甲苯.
,名称为邻二甲苯.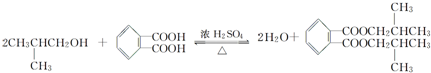 .
.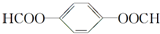 ;X分子中有2种不同化学环境的氢原子,其峰面积之比为1:2;1mol X与NaOH溶液共热反应,最多消耗4 mol NaOH.
;X分子中有2种不同化学环境的氢原子,其峰面积之比为1:2;1mol X与NaOH溶液共热反应,最多消耗4 mol NaOH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com