
【题目】室温下将40g已磨成粉末的![]() 和
和![]() 置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
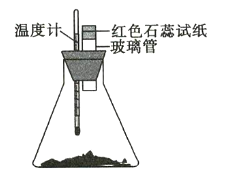
(1)湿润的红色石蕊试纸发生的变化是_________________,其原因是_______。
(2)温度计的变化是_______________________,其原因是_______________________ 。
(3)锥形瓶中发生反应的化学方程式为__________ 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:

已知:![]() ,根据以上的实验操作和现象,该同学得出的结论不正确的是
,根据以上的实验操作和现象,该同学得出的结论不正确的是![]()
A.试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]()
B.试样中一定不含![]()
C.试样中可能存在![]() 、
、![]()
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份20mL该溶液进行如下实验:
,现取三份20mL该溶液进行如下实验:
![]() 第一份加入足量盐酸,无任何气体产生
第一份加入足量盐酸,无任何气体产生
![]() 第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
![]() 第三份滴加
第三份滴加![]() 酸性
酸性![]() 溶液,恰好完全反应,消耗其体积为VmL
溶液,恰好完全反应,消耗其体积为VmL
![]() 另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是![]()
A.由实验![]() 、
、![]() 可判定原混合溶液中是否存在
可判定原混合溶液中是否存在![]()
B.由实验![]() 可推断原混合溶液中是否含有
可推断原混合溶液中是否含有![]()
C.由实验![]() 可判定原混合溶液中是否含有
可判定原混合溶液中是否含有![]()
D.原混合溶液中只存在![]() 、
、![]() 、
、![]() ,不可能存在
,不可能存在![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
共同生产干电池的原料Zn和![]() ,同时获得一些副产品,工艺流程如下:
,同时获得一些副产品,工艺流程如下:
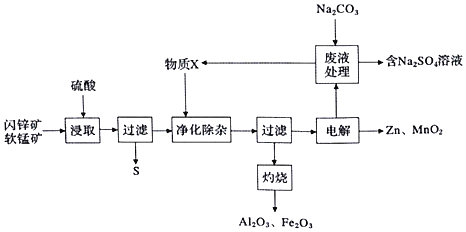
已知:硫酸浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]()
![]() “浸取“时发生的反应中,还原产物为______
“浸取“时发生的反应中,还原产物为______![]() 填化学式
填化学式![]()
![]() “净化除杂”时,加入的物质X可能为______
“净化除杂”时,加入的物质X可能为______![]() 填选项字母
填选项字母![]()
A.![]() B.
B.![]()
![]()
![]()
![]() “电解”时,发生反应的化学方程式为______
“电解”时,发生反应的化学方程式为______
![]() 从
从![]() ,溶液中得到芒硝晶体
,溶液中得到芒硝晶体![]() ,需要进行的实验操作有______、______过滤、洗涤、干燥等
,需要进行的实验操作有______、______过滤、洗涤、干燥等
![]() 和
和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
![]() 已知:
已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() 的pH______
的pH______![]() 填“或“
填“或“![]() ”
”![]() 在废水处理领域中常用
在废水处理领域中常用![]() 将
将![]() 转化为MnS除去,向含有
转化为MnS除去,向含有![]() 废水中通人一定量的
废水中通人一定量的![]() 气体,调节溶液的
气体,调节溶液的![]() ,当
,当![]() 浓度为
浓度为![]() 时,
时,![]() 开始沉淀,则
开始沉淀,则![]() ______。
______。![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿
是一种常见的强氧化剂,主要用于防腐、化工、制药等。现以某种软锰矿![]() 主要成分
主要成分![]() ,还有
,还有![]() 、
、![]() 、
、![]() 等
等![]() 作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
作脱硫剂,通过如下简化流程既脱除燃煤尾气中的![]() ,又制得
,又制得![]() 反应条件已经省略
反应条件已经省略![]() 。
。
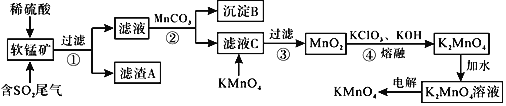
已知:![]() ,
,![]() 回答下列问题:
回答下列问题:
![]() 滤渣A的成分是
滤渣A的成分是![]() 写化学式
写化学式![]() ______。
______。
![]() 析出沉淀B时,首先析出的物质是
析出沉淀B时,首先析出的物质是![]() 写化学式
写化学式![]() ______。
______。
![]() 步骤2中加入
步骤2中加入![]() 的作用为______。
的作用为______。
![]() 滤液C中加入
滤液C中加入![]() 时发生反应的离子方程式是______。
时发生反应的离子方程式是______。
![]() 完成步骤4中反应的化学方程式______
完成步骤4中反应的化学方程式______![]() ______
______![]() ______
______![]() ______
______

![]() 电解制备
电解制备![]() 的装置如图所示。电解液中最好选择______离子交换膜
的装置如图所示。电解液中最好选择______离子交换膜![]() 填“阳”或“阴”
填“阳”或“阴”![]() 。电解时,阳极的电极反应式为______。
。电解时,阳极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列反应并按要求填空。
(1) 铁与氯气在一定条件反应,写出化学反应方程式 _________________其中氧化剂是____________;发生氧化反应的是____________,当1molFe反应时转移_____mol电子
(2)取少量铁与氯气反应得到的固体溶于水,分装在两只试管中,若向其中一支试管滴加KSCN溶液,则溶液变成_____色。向另一支试管滴加NaOH溶液,现象为_________________ 离子反应的方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com