
����Ŀ�������¼������ӣ�X��Y��Z�������ӣ�Q�������ӣ�M��N�Ƿ��ӣ���Z���������Ӷ��ɶ�����Ԫ��A��B��C�е�һ�ֻ��ֹ��ɣ��Ҿ������½ṹ���������ʣ�
�����ǣ�X��Y��Z��Q��M��N�����������������ͬ��
��N����M�У������̪����Һ��죻
��Y��Q����A��B��Ԫ����ɣ�Y��������������Q��������
��X��N����A��C��Ԫ����ɣ�X��Y��������������ȣ�
��X��Q�γɵ�Ũ��Һ�ڼ������������M��N��
��ZΪ�������ӣ�����Z����Һ�м���������Q����Һ���а�ɫ�������ɣ��ټ�������ĺ�Q��Y����Һ��������ʧ��
��1��Q�Ļ�ѧʽΪ______��X�ĵ���ʽΪ______________.
��2���ԱȽ�M��N���ȶ��ԣ�N____M��
��3��д��Z��N��ˮ��Һ��Ӧ�����ӷ���ʽ___________________________��
��4�������������е����������ӿ���������γ�һ���Σ������ᾧˮ��������ε�Ũ��Һ����μ���0.2mol/L��NaOH��Һ����������ͼ��a��b��c�����ε�ͼ����ͼ���жϸ��εĻ�ѧʽΪ_______________��

��5����2.56gͭͶ�뵽һ������A��B��C����Ԫ���γɵ�һ�ֳ������������Һ�У����ռ���896mL���壨��״���£�����ʢ�д����������������ˮ���У�ͨ��һ������������ǡ��ʹ������ȫ����ˮ����ͨ�������ڱ�״���µ����________mL��
���𰸡� OH�� 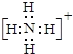 �� Al3++3NH3��H2O=Al��OH��3��+3NH4+ NH4Al��SO4��2 448
�� Al3++3NH3��H2O=Al��OH��3��+3NH4+ NH4Al��SO4��2 448
��������X��Y��Z�������ӣ�Q�������ӣ�M��N�Ƿ��ӣ����Ƕ��ɶ�����Ԫ����ɣ��Ҿ������½ṹ���������ʣ������ǵĺ��������������ͬ���ɢ�N����M�У������̪����Һ��죬��Һ�ʼ��ԣ�����֪NΪNH3��MΪH2O���ɢ�ZΪ�������ӣ�����Z����Һ�м���������Q����Һ���а�ɫ�������ɣ��ټ�������ĺ�Q��Y����Һ��������ʧ������֪ZΪAl3+��QΪOH-���ɢ�Y��Q����A��B��Ԫ����ɣ�Y������������Q��2������YΪH3O+���ɢ�X��N����A��C��Ԫ����ɣ�X��Y��������������ȣ���XΪNH4+���ɢ�笠�����������������Ũ��Һ�ڼ��������¿������ɰ�����ˮ������ת����ϵ����Ϣۢܿ�֪��AΪHԪ�ء�BΪOԪ�ء�CΪNԪ�ء�
(1)Q�Ļ�ѧʽΪOH-��笠����ӵĵ���ʽΪ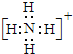 ���ʴ�Ϊ��OH-��
���ʴ�Ϊ��OH-��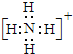 ��
��
(2)�ǽ�����Խǿ�⻯��Խ�ȶ����ǽ�����O��N������NΪNH3���ȶ�������MH2O���ȶ��ԣ��ʴ�Ϊ������
(3)�����ӺͰ���ˮ��Һ��Ӧ�����ӷ���ʽΪAl3++3NH3H2O=Al(OH)3��+3NH4+���ʴ�Ϊ��Al3++3NH3H2O=Al(OH)3��+3NH4+��
(4)��ͼ��֪��b�����������������䣬������������Ϊ1�����Ӧ����NH4+�����ܽ���������������������Ϊ1���������������笠�����֮��Ϊ1��1������εĻ�ѧʽΪNH4Al(SO4)2���ʴ�Ϊ��NH4Al(SO4)2��
(5)2.56gCu�����ʵ���Ϊ��n(Cu)=![]() =0.04mol����Ӧʱʧȥ����Ϊ��2��0.04mol=0.08mol����Ӧ��������ΪHNO3
=0.04mol����Ӧʱʧȥ����Ϊ��2��0.04mol=0.08mol����Ӧ��������ΪHNO3![]() NO��NO2
NO��NO2![]() HNO3����Ӧǰ��HNO3�����ʵ������䣬�����ϼ۱仯��ֻ��ͭ����������Cuʧȥ������Ŀ����O2�õ����ӵ���Ŀ�������������������ʵ���Ϊ��n(O2)=
HNO3����Ӧǰ��HNO3�����ʵ������䣬�����ϼ۱仯��ֻ��ͭ����������Cuʧȥ������Ŀ����O2�õ����ӵ���Ŀ�������������������ʵ���Ϊ��n(O2)=![]() =0.02mol���������Ҫ���������Ϊ��V(O2)=0.02mol��22.4L/mol=0.448L=448mL���ʴ�Ϊ��448��
=0.02mol���������Ҫ���������Ϊ��V(O2)=0.02mol��22.4L/mol=0.448L=448mL���ʴ�Ϊ��448��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�����������3��ʵ�鷽�������Լ�����۵�ˮ��̶ȣ�
����������Һ ![]() ˮ��Һ
ˮ��Һ ![]() �к�Һ
�к�Һ ![]() ��Һ����
��Һ����
���ۣ�������δˮ��
�ҷ���������Һ ![]() ˮ��Һ
ˮ��Һ ![]() ����������
����������
���ۣ�������δˮ��
������������Һ ![]() ˮ��Һ
ˮ��Һ ![]() �к�Һ
�к�Һ 
���ۣ�����ˮ����ȫ
�������ַ��������Ƿ���ȷ ˵�����ɡ��������ַ��������Ƿ���ȷ ˵�����ɡ� ______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��As2O3��ҽҩ�����ӵ���������ҪӦ�á�ij����Ԫ�أ�As���Ĺ�ҵ��ˮ����ͼ1����ת��Ϊ�ֲ�Ʒ��

��1�����������Ŀ���ǽ���ˮ�е�H3AsO3��H3AsO4ת��Ϊ�Ρ�H3AsO4ת��ΪNa3AsO4��Ӧ�Ļ�ѧ����ʽ��_______________________________��
��2����������ʱ��1molAsO33-ת��ΪAsO43-������ҪO2______ mol��
��3�������顱�ǽ���Ԫ��ת��ΪCa5(AsO4)3OH��������������Ҫ��Ӧ�У�
a��Ca(OH)2��s��![]() Ca2+��aq��+2OH-��aq�� ��H��0
Ca2+��aq��+2OH-��aq�� ��H��0
b��5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH ��H��0
Ca5(AsO4)3OH ��H��0
�о������������顱������¶���85�档 �û�ѧƽ��ԭ�������¶ȸ���85���,���¶����߳������½���ԭ����_____________________��
��4������ԭ��������H3AsO4ת��ΪH3AsO3����Ӧ�Ļ�ѧ����ʽ��_______________________��
��5������ԭ���������Һ��H3AsO3�ֽ�ΪAs2O3��ͬʱ�ᾧ�õ���As2O3��As2O3�ڲ�ͬ�¶ȺͲ�ͬŨ�������е��ܽ�ȣ�S��������ͼ2��ʾ��Ϊ����ߴ�As2O3�ij����ʣ����ᾧ�����̽��еIJ�����_______��

��6������˵���У���ȷ���� ______ ������ĸ����
a����As2O3���CaSO4
b����ҵ�����У���Һ2��ѭ��ʹ�ã������Ļ�����
c��ͨ���ȡ����顱���ữ����˳���Դﵽ������Ԫ�ص�Ŀ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ�������й�������ȷ���ǣ� ��
A. 1L0.1mol��L-1CH3COOH��Һ�к�H+����ĿΪ0.1NA
B. ��״����,2.24LCl2 ����ˮ,ת�Ƶĵ�����Ϊ0.1NA
C. 100g��������Ϊ46%�ľƾ���Һ�к���ԭ������Ϊ4NA
D. �����£���1molFe��������������,����H2�ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ��Ϊ�� ��
A.����Ħ���������22.4 L/mol
B.1 mol H2������ֻ���ڱ���²�ԼΪ2 g
C.����£�18��H2O�����Ϊ22.4 L
D.H2��O2�Ļ������1 mol�ڱ���µ����ԼΪ22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д���������ǣ���
A.K����Ag����NO3����Cl��B.Ba2����Na����CO32����OH��
C.Al3����Fe3����SO42����Cl��D.H����K����CO32����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ������ʵ���У�������������Һ�еμ����������������ݵ������ȱ仯�ǣ�����������������˵����ȷ���ǣ���
A.��Һ�ĵ���������Һ�����ӵ�Ũ���й�
B.��Һ�ĵ���������Һ��������Ŀ�Ķ����й�
C.ǡ����ȫ��Ӧʱ����Һ�����磬����BaSO4��ˮ�����������
D.������������Һ�еμ�������μ�����ʱ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�����Ԫ�ص����ʿɷ�����ͼ��ʾ��ѭ��ת����

�ش��������⣺
��1������ԭ�ӽṹʾ��ͼΪ_________��
��2��ͼ�����ڡ����Ĺ̶�������_________(����ĸ����ͬ);ת�������з�����������ԭ��Ӧ����_________��
��3��������Ӧh������NO2��H2O��������ʵ��,��÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ_________��
��4��������Ӧi������������������NO3-��Zn������ʵ��,��÷�Ӧ�����ӷ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п����������п���ס�ӡȾýȾ���ȡ���п����Ҫ�ɷ�ΪZnO��������FeO��CuO��SiO2�����ʣ��Ʊ�ZnSO4��7H2O���������¡�
��֪��Ksp[Fe(OH)3]��4.0��1038��Ksp[Cu(OH)2]��2.2��1020

��1��������1������Ҫ�ɷ���_______���ѧʽ����������������У�Ϊ�����пԪ�ؽ������ʣ��ɲ�ȡ�Ĵ�ʩ�У����ʵ�������Ũ�ȣ���_______����һ������
��2����������������������������ԭ��Ӧ�����ӷ���ʽ��_______��
��3���������������У�����ZnO����Fe(OH)3������ԭ����_______��
��4����������ZnO���壬��ֻ����Fe(OH)3������δ����Cu(OH)2�������Ҳ�ó��������Һ��c(Fe3��)��4.0��1014mol/L����ʱ��Һ��c(Cu2��)��ȡֵ��Χ��_______mol/L��
��5����������п�۵�������_______��
��6������Һ�õ�ZnSO47H2O�IJ�������Ϊ_______��_______�����ˡ�ϴ�ӡ����ʵ�����й��˲�����Ҫʹ�õIJ����������ձ���_______��_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com