
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________,属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。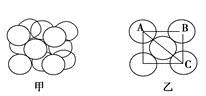
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大。A是短周期元素中原子半径最小的元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为淡黄色晶体。
(1)写出E元素在周期表中的位置 ;
(2)写出C元素的离子结构示意图 ;
(3)写出化合物A2B的电子式 ;
(4)写出C、D的最高价氧化物对应水化物相互反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(2)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,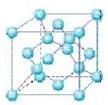 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C< B < E< D
Ⅱ.原子的最外层电子数:A=D C=E A + B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)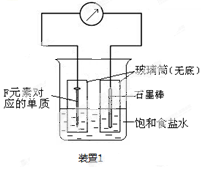
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某元素X的同位素构成的气态双原子分子有三种,相对分子质量分别为70、72、74。此三种分子的物质的量之比是9∶6∶l,请回答:
(1)X元素有几种同位素?质量数分别是多少?
(2)各同位素的原子数之比是多少?
(3)X元素的近似相对原子质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学键与化合物的叙述正确的是
①离子化合物中一定含有金属元素 ②共价化合物中一定不含有金属元素 ③离子化合物中一定含有离子键 ④离子化合物中一定不含有共价键 ⑤离子化合物中可能含有共价键 ⑥共价化合物中可能含有离子键 ⑦共价化合物中一定不含有离子键
| A.①⑤⑥⑦ | B.②③④ | C.③⑤⑦ | D.②③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com