
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值
D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定
【知识点】实验的设计和实验操作 J1 H1 H3
【答案解析】C 解析:A、测定相同浓度的NaCl溶液和Na2S溶液的pH值,只能说明HCl和H2S的酸性强弱,无法比较Cl与S元素的非金属性强弱,因为元素非金属性的强弱可以通过比较它们最高价氧化物的水化物酸性强弱得到,故A错误;B、如果用坩埚钳夹持Mg条点燃后迅速投入上述集气瓶底部会造成集气瓶炸裂,操作错误,故B错误;C、用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值,根据碱性的强弱可以得到HA和HB两种弱酸的相对强弱从而得到Ka的相对大小,故C正确;D、操作复杂,设计不合理,可以通过检验碳酸根离子的存在得到NaOH溶液放置空气中是否部分转化为Na2CO3,故D错误。
故答案选C
【思路点拨】本题考查了实验的设计和实验操作,实验设计要简单易行、科学合理。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
高氯酸铵(NH4ClO4)加热至483 K时,可完全分解成N2、Cl2、O2和H2O,则反应中氧化产物与还原产物的物质的量之比是( )
A.1∶1 B.1∶3 C.2∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有5 mL 0.005 mol·L-1 FeCl3溶液的试管中加入5 mL 0.01 mol·L-1 KSCN溶液,充分混匀,溶液颜色深浅不再变化后建立化学平衡FeCl3+3KSCN
 Fe(SCN)3+3KCl。下列叙述中,不正确的是( )
Fe(SCN)3+3KCl。下列叙述中,不正确的是( )
A.加水至溶液的体积加倍,溶液红色变浅,但化学平衡不移动
B.再滴加少量0.1 mol·L-1 KCl溶液,溶液红色变浅,化学平衡左移
C.再滴加少量0.1 mol·L-1 NaOH溶液,会有红褐色沉淀产生,上部溶液红色变浅,化学平衡左移
D.再滴加少量0.1 mol·L-1 FeCl3溶液,溶液红色变深,化学平衡右移
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,固定容积的密闭容器中有如下反应:2NO2(g)
 O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )

①当X表示温度时,Y表示NO2的物质的量 ②当X表示压强时,Y表示NO2的转化率 ③当X表示反应时间时,Y表示混合气体的密度 ④当X表示NO2的物质的量时,Y表示O2的物质的量
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
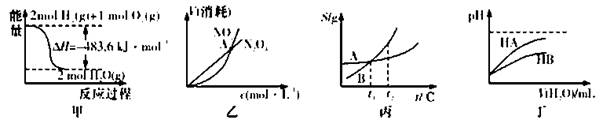
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析:
①漂白粉和酸雨都是混合物;
②煤和石油都是可再生能源;
③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
④不锈钢和目前流通的硬币都是合金:
⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
⑥豆浆和雾都是胶体。
上述说法正确的是
A.①②④⑤ B.①②⑤⑥ C.①③④⑥ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,
加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c (H+)=10-13mol/L
B.所得溶液中由水电离产生的c (OH-)=10-13 mol/L
C.所加的烧碱溶液的pH=13.0
D.所得溶液中的c (Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图中装置,可以模拟铁的电化学防护。下列有关说法正确的是(双选)( )。

A.若X为碳棒,开关K置于M处,达到防护铁闸门的目的
B.若X为碳棒,开关K置于N处比未闭合时铁闸门腐蚀得更快
C.若X为碳棒,开关K置于N处,一段时间后,该海水中滴加K3[Fe(CN)6]溶液无明显现象
D.若X为锌棒,开关K置于M处,铁闸门被保护
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com